Đề thi thử THPT Quốc Gia môn Hóa trường THPT Chuyên Biên Hòa Hà Nam lần 2 năm 2016 Mã...
Câu hỏi 1 :
Hòa tan hoàn toàn 10,8 gam Ag bằng dung dịch HNO3, thu được V lít NO2 (đktc) (là sản phẩm khử duy nhất của N+5). Giá trị của V là
A 1,12.
B 2,24.
C 3,36.
D 0,10.
Câu hỏi 2 :
Kim loại Cu không phản ứng với chất nào sau đây trong dung dịch?
A H2SO4 đặc.
B HCl.
C FeCl3.
D AgNO3.
Câu hỏi 3 :
aminoaxit X mạch hở(trong phân tử chỉ chứa nhóm chức - NH2 và nhóm -COOH. 0,1 mol X phản ứng vừa đủ với 0,1 lít dung dịch HCl 1M. Đốt cháy hoàn toàn a gam X, sản phẩm cháy được hấp thụ hoàn toàn vào 250 gam dung dịch Ba(OH)2 17,1% , sau hấp thụ thu được 27,58 gam kết tủa và 245,82 gam dung dịch Q. Giá trị của a là
A 11,44
B 9,63
C 12,35
D 10,68
Câu hỏi 4 :
Lưu huỳnh trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A Na2S.
B SO3.
C SO2.
D H2S.
Câu hỏi 5 :
Dung dịch X và dung dịch Y là các dung dịch HCl với nồng độ mol tương ứng là C1 và C2 (Mol/lít), trong đó C1 > C2. Trộn 150 ml dung dịch X với 500 ml dung dịch Y, thu được dung dịch Z. Để trung hòa 1/10 dung dịch Z cần 10 ml dung dịch hỗn hợp NaOH 1 M và Ba(OH)2 0,25 M. Mặt khác lấy V1 lít dung dịch X chứa 0,05 mol HCl trộn với V2 lít dung dịch Y chứa 0,15 mol HCl thu được 1,1 lít dung dịch.Giá trị của C1 và C2 tương ứng là:
A 0,5 và 0,15
B 0,6 và 0,25
C 0,45 và 0,10
D 1/11 và 3/11
Câu hỏi 6 :
Khi làm thí nghiệm với HNO3 đặc, nóng thường sinh ra khí NO2. Để hạn chế tốt nhất khí NO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A Giấm ăn.
B Muối ăn.
C Nước.
D Xút.
Câu hỏi 7 :
Phương pháp chung để điều chế các kim loại Na, K trong công nghiệp là
A điện phân dung dịch.
B nhiệt luyện.
C thủy luyện.
D điện phân nóng chảy.
Câu hỏi 8 :
Hấp thụ hết 8,96 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 400 ml dung dịch X. Lấy 200 ml dung dịch X cho từ từ vào 600 ml dung dịch HCl 0,5M, thu được 5,376 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
A 0,3.
B 0,2.
C 0,1.
D 0,12.
Câu hỏi 9 :
Hòa tan hết 2,3 gam Na vào 300 ml dung dịch HCl 0,2 M, thu được dung dịch X. Cho dung dịch AgNO3 dư vào X đến phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A 10,21
B 8,61
C 13,61
D 13,25
Câu hỏi 10 :
Phát biểu nào sau đây sai?
A NaCl được dùng để điều chế NaOH, Cl2 trong công nghiệp.
B Nước Javen có thành phần là NaCl, NaClO.
C Trong tự nhiên, các halogen chủ yếu tồn tại ở dạng đơn chất.
D Phương pháp sunfat có thể dùng để điều chế HCl, HNO3.
Câu hỏi 12 :
Chất nào sau khi phản ứng với dung dịch KOH tạo ra muối và anđehit?
A etyl fomat
B metyl axetat
C phenyl butirat
D vinyl benzoat
Câu hỏi 13 :
Dung dịch chất nào sau không làm hồng phenolphtalein?
A lysin
B metylamin
C glyxin
D natri axetat
Câu hỏi 14 :
Hòa tan hoàn toàn 25,68 gam hỗn hợp gồm Fe, Al và Mg có số mol bằng nhau trong dung dịch HNO3 loãng (dư), thu được dung dịch X chứa 150,72 gam muối và hỗn hợp khí A gồm N2, N2O, NO, và NO2. Trong A, phần trăm số mol N2 bằng phần trăm số mol NO2. Biết tỉ khối của A so với H2 bằng 18,5. Số mol HNO3 đã tham gia phản ứng là
A 2,430 mol.
B 2,160 mol.
C 2,280 mol.
D 2,550 mol.
Câu hỏi 15 :
Trong các chất: ancol propylic, metylfomat, axit butiric và etilen glycol, chất có nhiệt độ sôi nhỏ nhất là
A axit oxalic
B metylfomat
C axit butiric
D etilen glycol
Câu hỏi 16 :
Hiđrocacbon nào sau phản ứng với dung dịch AgNO3/NH3 tạo được kết tủa?
A metan
B propen
C etin
D but-2-in
Câu hỏi 17 :
Chất nào sau vừa phản ứng được với dung dịch KOH, vừa phản ứng với dung dịch AgNO3/NH3 tạo Ag?
A axit axetic
B etanal
C vinyl axetat
D etyl fomat
Câu hỏi 18 :
Cho sơ đồ phản ứng sau: 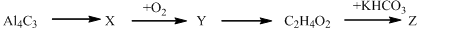 Nhận xét nào sau về các chất X,Y,Z trong sơ đồ trên là đúng?
Nhận xét nào sau về các chất X,Y,Z trong sơ đồ trên là đúng?
A Chất X phản ứng với dung dịch AgNO3/NH3 tạo kết tủa.
B Chất Y điều kiện thường ở trạng thái lỏng, tan tốt trong H2O và phản ứng với Na tạo H2
C Chất Z có phản ứng tráng bạc
D Trong thành phần của Y chỉ có hai nguyên tố.
Câu hỏi 20 :
Khả năng thế vào vòng benzen giảm theo thứ tự là
A phenol > benzen > nitrobenzen
B phenol > nitrobenzen > benzen
C nitrobenzen > phenol > benzen
D benzen > phenol > nitrobenzen
Câu hỏi 21 :
Thuỷ phân hết m gam tetrapeptit Ala-Ala-Ala-Ala (mạch hở) thu được hỗn hợp gồm 28,48 gam Ala, 32 gam Ala-Ala và 27,72 gam Ala-Ala-Ala. Giá trị của m là:
A 81,54
B 66,44
C 111,74
D 90,6
Câu hỏi 23 :
Amin X đơn chức. cho 0,1 mol X phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được 8,15 gam muối. %mC trong X có giá trị là
A 44,44%
B 37,12%
C 53,33%
D 66,67%
Câu hỏi 24 :
Este X đơn chức, trong X có %mO = 26,229 %. Cho 0,1 mol X phản ứng với dung dịch NaOH vừa đủ, thu được 18,4 gam muối. Nhận xét nào sau về X là đúng?
A X làm mất màu dung dịch Br2.
B X tan tốt trong H2O
C X được điều chế trực tiếp từ một axit và một ancol.
D Trong X không có nhóm (-CH2-)
Câu hỏi 25 :
Chất hữu cơ X (C,H,O), mạch hở, có phân tử khối bằng 86 . Chất X vừa phản ứng với KOH tạo ancol, vừa có phản ứng tráng bạc. Nhận xét nào sau về X là đúng?
A Chất X là hợp chất tạp chức
B Chất X không tan được vào benzen
C Trong X có nH = nC + nO.
D Chất X phản ứng với KHCO3 tạo CO2.
Câu hỏi 26 :
Cho 6 gam một axit hữu cơ đơn chức(X) phản ứng hoàn toàn với lượng dư dung dịch KHCO3, thu được 2,24 lít khí ở đktc. Nhận xét nào sau về X là đúng?
A Chất X không tan trong H2O
B trong công nghiệp X được điều chế trực tiếp từ butan
C Chất X làm mất màu dung dịch Br2.
D Trong X có nH = nO = nC.
Câu hỏi 27 :
Hỗn hợp X gồm metanal và axit fomic. Cho 9,58 gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3/NH3 thu được 79,92 gam Ag. %m của metanal trong X có giá trị là
A 37,57%
B 42,51%
C 51,16%
D 62,22%
Câu hỏi 28 :
Axit cacboxylic X mạch hở, không làm mất màu dung dịch Br2. Khi đốt cháy X tạo CO2 và H2O thỏa mãn nH2O = nCO2 – nX. Axít X thuộc loại
A no,mạch hở, đơn chức
B không no, một liên kết đôi, đơn chức
C no, mạch hở, hai chức
D no, mạch hở, ba chức
Câu hỏi 29 :
Chất hữu cơ X vừa phản ứng với Cu(OH)2, vừa phản ứng với Na tạo H2. X được điều chế trực tiếp từ một anken Y có cùng số nguyên tử C với X. Đốt cháy 0,1 mol X, sản phẩm cháy hấp thụ hoàn toàn vào 150 gam dung dịch Ba(OH)2 17,1%, sau hấp thụ được x gam kết tủa và y gam dung dịch P. giá trị tương ứng của x và y là
A 19,7 và 152,4
B 19,7 và 144,5
C 29,55 và 152,4
D 27,58 và 144,5
Câu hỏi 30 :
Hỗn hợp X gồm a mol Fe, b mol FeCO3 và c mol FeS2. Cho X vào bình dung tích không đổi chứa không khí (dư), nung bình đến khi các phản ứng xảy ra hoàn toàn sau đó đưa bình về nhiệt độ ban đầu, thấy áp suất trong bình bằng áp suất trước khi nung. Quan hệ của a, b, c là
A a = b+c.
B 4a+4c=3b.
C b=c+a.
D a+c=2b.
Câu hỏi 31 :
Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X, khối lượng dung dịch giảm 21,5 gam so vơi trước điện phân. Cho thanh sắt vào X đến khi các phản ứng xảy ra hoàn toàn, khối lượng thành sắt giảm 2,6 gam và thoát ra khí NO duy nhất. Giá trị của x là
A 0,2.
B 0,3.
C 0,5.
D 0,4.
Câu hỏi 32 :
Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
A Ba2+.
B Fe3+.
C Cu2+.
D Pb2+.
Câu hỏi 34 :
Nhận xét nào sau về phenol không đúng?
A ở điều kiện thường phenol rất ít tan trong H2O
B Phenol vừa phản ứng được với dung dịch KOH, vừa phản ứng được với dung dịch Br2.
C Trong công nghiệp phenol được tạo ra khi oxihóa cumen
D phenol phản ứng với CH3COOH tạo ra este.
Câu hỏi 35 :
Chất hữu cơ X (C,H,O), chất Y là một ancol , mạch hở, cả X và Y đều có nC < 4. Hỗn hợp Q gồm X, Y, trong đó phần trăm khối lượng của Y là x %. Đốt cháy hoàn toàn 0,24 mol Q(X,Y), sản phẩm cháy được hấp thụ hết vào 300 gam dung dịch Ba(OH)2 17,1%, sau hấp thụ thu được 27,58 gam kết tủa và 300,94 gam dung dịch P. Mặt khác 0,24 mol Q phản ứng hoàn toàn với lượng dư dung dịch KHCO3, thu được y lít CO2(đktc). Giá trị tương ứng của x và y là
A 51,62 và 2,912
B 55,56 và 3,122
C 62,7 và 4,12
D 74,2 và 2,912
Câu hỏi 36 :
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A Ca(OH)2 + Cl2 -> CaOCl2 + H2O.
B 2KClO3 -> 2KCl + 3O2.
C C2H4 + Cl2 -> C2H4Cl2 .
D 2Fe(OH)3 -> Fe2O3 + 2H2O.
Câu hỏi 37 :
Cấu hình electron của nguyên tử nguyên tố X ở trạng thái cơ bản là 1s22s22p63s23p4. Số hiệu nguyên tử của X là
A 14.
B 32.
C 16.
D 18.
Câu hỏi 39 :
Thực hiện các thí nghiệm sau ở điều kiện thường: (a) Sục khí H2S vào dung dịch AgNO3 (b) Cho CaCO3 vào H2O. (c) Cho SiO2 vào dung dịch HF. (d) Sục khí Cl2 vào dung dịch KOH. Số thí nghiệm xảy ra phản ứng là
A 3
B 4
C 2
D 1
Câu hỏi 40 :
Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước?
A Al.
B K.
C Ca.
D Cu.
Câu hỏi 41 :
Đốt cháy hoàn toàn m gam Fe trong khí S dư, thu được 8,8 gam FeS. Giá trị của m là
A 5,6.
B 2,80.
C 8,4.
D 3,2.
Câu hỏi 42 :
Hòa tan hoàn toàn 19,5 gam Zn và 4,8 gam Mg bằng dung dịch H2SO4 loãng, thu được V lít H2 (đktc). Giá trị của V là
A 11,2.
B 22,4.
C 6,72.
D 4,48.
Câu hỏi 43 :
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng, đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
A 17,6.
B 23,2
C 19,8 .
D 20,8 .
Câu hỏi 44 :
Este X mạch hở. Cho m gam X phản ứng vừa đủ với dung dịch NaOH 1M, thu được ancol Y và 26,16 gam hỗn hợp Q gồm 2 muối (số nguyên tử C trong mỗi muối đều nhỏ hơn 4). Đốt cháy hoàn toàn lượng ancol trên, tạo ra 0,36 mol CO2 và 0,48 mol H2O. Giá trị của m là
A 22,8
B 27,5
C 31,2
D 19,8
Câu hỏi 45 :
Cho 1,2 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 1,12 lít H2 (đktc). Kim loại đó là
A Ba.
B Mg.
C Ca.
D Sr.
Câu hỏi 46 :
Cho các dung dịch: Na2CO3, Na2SO3, Na2SO4, Na2S. Số thuốc thử tối thiểu cần để phân biệt các chất trên là:
A 1
B 4
C 2
D 3
Câu hỏi 47 :
Trong các polime: sợi visco, sợi lapsan, chất dẻo PVC, cao su buna và chất dẻo teflon, số polime được tạo ra bằng phản ứng trùng hợp là
A 4
B 3
C 2
D 1
Câu hỏi 48 :
Ba chất hữu cơ X,Y,Z thành phần đều gồm C,H,O, đều có phân tử khối bằng 74, trong đó X,Y là đồng phân của nhau. Hỗn hợp Q( X,Y, Z). Cho 0,35 mol hỗn hợp Q phản ứng hoàn toàn với lượng dư dung dịch KHCO3, thu được 5,152 lít CO2(đktc). Mặt khác 0,35 mol Q phản ứng hoàn toàn với lượng dư dung dịch AgNO3/NH3, thu được 54 gam Ag. Phần trăm khối lượng của Z trong Q có giá trị là
A 47,11%
B 37,14%
C 39,22%
D 49,33 %
Câu hỏi 49 :
Sản phẩm chính tạo ra khi cho propin phản ứng với H2O(Hg2+,H+,to) có tên gọi là
A ancol isopropylic
B đietylxeton
C propan-1-ol
D axeton
Câu hỏi 50 :
X,Y là hai nguyên tố kim loại kiềm. Cho 17,55 gam X vào H2O thu được dd Q. Cho 14,95 gam Y vào H2O được dd P. Cho dd Q hoặc P vào dd chứa 0,2 mol AlCl3 đều thu được y gam kết tủa. Các phản ứng xảy ra hoàn toàn. Kim loại Y và giá trị của y là
A K và 15,6
B Na và 15,6
C Na và 11,7
D Li và 11,7
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK
