Đề thi thử THPT Quốc Gia ĐH môn hóa năm 2016, Đề 5 ()
Câu hỏi 1 :
Sản phẩm chính tạo thành khi cho 2-brombutan với dung dịch KOH/ancol, đun nóng
A but-2-ol
B but-2-ol
C metylxiclopropan.
D But-2-en.
Câu hỏi 2 :
Thí nghiệm trên đây dùng để 
A Phân tích đinh tính nguyên tố cacbon
B Phân tích định lượng nguyên tố hydro
C Phân tích đinh lượng nguyên tố cacbon, hydro.
D Phân tích định tính nguyên tố cacbon, hydro
Câu hỏi 3 :
Hòa tan hết 26,43 gam hỗn hợp bột gồm Mg, Al, Al2O3 và MgO bằng 795 ml dung dịch hỗn hợp gồm HCl 0,5M và H2SO4 0,75M (vừa đủ). Sau phản ứng thu được dung dịch X và 4,368 lít khí H2 (ở đktc). Cô cạn dung dịch X thu được khối lượng muối khan là
A 95,92 gam.
B 86,58 gam.
C 100,52 gam.
D 88,18 gam.
Câu hỏi 4 :
Đốt cháy hoàn toàn 0,10 mol hỗn hợp hai axit cacboxylic là đồng đẳng kế tiếp thu được 3,360 lít CO2 (đktc) và 2,70 gam H2O. Số mol của mỗi axit lần lượt là:
A 0,045 và 0,055.
B 0,060 và 0,040.
C 0,050 và 0,050.
D 0,040 và 0,060.
Câu hỏi 5 :
Hợp chất hữu cơ C4H7O2Cl khi thủy phân trong môi trường kiềm được các sản phẩm trong đó có hai chất có khả năng tráng gương. Công thức cấu tạo đúng là:
A C2H5COO-CH2-CH3.
B HCOO-CH2-CHCl-CH3.
C HCOOCHCl-CH2-CH3.
D CH3 CH2COO-CH2Cl.
Câu hỏi 6 :
Một hỗn hợp X gồm 2 este. Nếu đun nóng 15,7g hỗn hợp X với dung dịch NaOH dư thì thu được một muối của axit hữu cơ đơn chức và 7,6 gam hỗn hợp hai ancol no đơn chức bậc 1 kế tiếp nhau trong dãy đồng đẳng. Mặt khác nếu 15,7gam hỗn hợp X cần dùng vừa đủ 21,84 lit O2 (đktc) và thu được 17,92 lít CO2 (đktc). Xác định công thức của 2 este:
A C2H5COOC2H5 và C2H5COOC3H7.
B C2H3COOC2H5 và C2H3COOC3H7.
C CH3COOC2H5 và CH3COOC3H7
D C2H3COOCH3 và C2H3COOC2H5
Câu hỏi 7 :
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s2, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p63s23p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A cộng hoá trị.
B ion.
C kim loại.
D cho nhận.
Câu hỏi 8 :
Nhỏ từ từ cho đến dư dung dịch HCl vào dung dịch Ba[Al(OH)4]2. Hiện tượng xảy ra:
A Có kết tủa keo trắng , sau đó kết tủa tan
B Chỉ có kết tủa keo trắng.
C Không có kết tủa, có khí bay lên.
D Có kết tủa keo trắng và có khi bay lên.
Câu hỏi 9 :
Để chứng minh ảnh hưởng của nhóm –OH lên vòng benzen trong phenol người ta thực hiện phản ứng:
A Phenol tác dụng với NaOH và với dung dịch brôm
B Phenol tác dụng với dung dịch Br2 tạo kết tủa trắng
C Phenol tác dụng với Na giải phóng H2
D phản ứng trùng ngưng của phenol với HCHO
Câu hỏi 10 :
Hỗn hợp X gồm hidrocacbon B với H2 (dư), có dX/H2 = 4,8. Cho Xđi qua Ni nung nóng đến phản ứng hoàn toàn được hỗn hợp Y có dY/H2 = 8 . Công thức phân tử của hidrocacbon B là :
A C4H8.
B C2H2.
C C3H6.
D C3H4.
Câu hỏi 11 :
Cho các chất: AgNO3, Cu(NO3)2, MgCO3, Ba(HCO3)2, NH4HCO3, NH4NO3 và Fe(NO3)2. Nếu nung các chất trên đến khối lượng không đổi trong các bình kín không có không khí, rồi cho nước vào các bình, số bình có thể tạo lại chất ban đầu sau các thí nghiệm là
A 4
B 5
C 6
D 3
Câu hỏi 12 :
X là hợp chất hữu cơ có CTPT C5H11O2N. Đun X với dung dịch NaOH thu được một hỗn hợp chất có CTPT C2H4O2NNa và chất hữu cơ Y, cho hơi Y đi qua CuO/t0 thu được chất hữu cơ Z có khả năng tham gia phản ứng tráng gương. CTCT của X là:
A H2NCH2CH2COOCH2CH3
B CH3(CH2)4NO2
C H2NCH2COOCH2CH2CH3
D H2NCH2COOCH(CH3)2
Câu hỏi 14 :
Phản ứng nào chứng minh axit axetic có tính axit mạnh hơn tính axit của phenol?
A C6H5OH + NaOH ® C6H5ONa + H2O.
B CH3COOH + C6H5ONa → CH3COONa + C6H5OH
C 2CH3COOH + Ca → (CH3COO)2Ca + H2.
D CH3COONa + C6H5OH → CH3COOH + C6H5ONa.
Câu hỏi 15 :
Cho sơ đồ: ![CH_{2}=CH_{2}\xrightarrow[PbCl_{2},CuCl_{2}]{+O_{2},t^{0}}\rightarrow B\overset{+HCN}{\rightarrow}D\overset{+H_{3}O^{+}}{\rightarrow}E](http://images.tuyensinh247.com/picture/learning/exam/2015/0115/79347_568836_1.gif) Biết B, D, E là các chất hữu cơ. Chất E có tên gọi là
Biết B, D, E là các chất hữu cơ. Chất E có tên gọi là
A axit 2-hiđroxipropanoic.
B axit propanoic.
C axit acrylic.
D axít axetic.
Câu hỏi 16 :
Hòa tan hết 17,84 gam hỗn hợp A gồm ba kim loại là sắt, bạc và đồng bằng 203,4 ml dung dịch HNO3 20% (d=1,115 g/ml) vừa đủ. Có 4,032 lít khí NO duy nhất thoát ra (đktc) và còn lại dung dịch B. Đem cô cạn dung dịch B, thu được m gam hỗn hợp các muối khan. Trị số của m là:
A 51,32 gam
B 45,64 gam
C 54,28 gam
D 60,27 gam
Câu hỏi 17 :
Đốt cháy hoàn toàn a gam hỗn hợp 2 ancol đơn chức là đồng đẳng kế tiếp nhau. Sau đó dẫn toàn bộ sản phẩm lần lượt qua bình một đựng H2SO4 đặc, rồi qua bình hai đựng nước vôi trong dư, thấy khối lượng bình một tăng 1,53 gam và bình hai xuất hiện 6 gam kết tủa. Công thức phân tử của hai ancol và giá trị của a là
A C2H6O và C3H8O; 1,29 gam
B CH4O và C2H6O; 1,92 gam.
C C3H8O và C4H10O; 2,67 gam
D C3H6O và C4H8O; 3,12 gam
Câu hỏi 18 :
Cho các phản ứng sau:a) Cu + HNO3 loãng → b) Fe2O3 + H2SO4 đặc, nóng →c) FeS2 + dung dịch HCl → d) NO2 + dung dịch NaOH → e) HCHO + Br2 → f) glucozơ 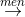 g) C2H6 + Cl2
g) C2H6 + Cl2 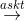 h) glixerol + Cu(OH)2 → Các phản ứng thuộc loại phản ứng oxi hóa - khử là
h) glixerol + Cu(OH)2 → Các phản ứng thuộc loại phản ứng oxi hóa - khử là
A a, c, d, e, f, g
B a, c, d, g, h
C a, d, e, f, g
D a, b, c, d, e, h
Câu hỏi 19 :
Tỉ khối hơi của 2 andehit no, đơn chức đối với oxi < 2 . Đốt cháy hoàn toàn m gam hỗn hợp gồm hai andehit trên thu được 7,04 gam CO2 . Khi cho m gam hỗn hợp trên phản ứng hoàn toàn với AgNO3 dư trong dung dịch NH3 thu được 12,96 gam Ag . Công thức phân tử của hai andehit và thành phần % khối lượng của chúng là
A HCHO: 13,82% ; CH3CH2CHO : 86,18%.
B CH3CHO: 27,5% ; CH3CH2CHO : 72,5%.
C HCHO : 20,5% ; CH3CHO : 79,5%.
D HCHO : 12,82% ; CH3CH2CHO : 87,18%
Câu hỏi 20 :
Hoà tan 2,08 gam hỗn hợp bột gồm FeS, FeS2, S bằng dung dịch H2SO4 đặc nóng dư thu được 2,688 lít SO2 (sản phẩm khử duy nhất, ở đktc và dung dịch X.Cho dung dịch X tác dụng với dung dịch NaOH dư, lọc lấy toàn bộ kết tủa nung trong không khí đến khối lượng không đổi thì khối lượng chất rắn thu được là:
A 10,7 gam
B 8,2 gam
C 1,6 gam
D 9 gam
Câu hỏi 21 :
Cho 200 ml dung dịch hỗn hợp Na2CO3 0,6M và K2SO4 0,4M tác dụng vừa đủ với 100 ml dung dịch hỗn hợp Pb(NO3)2 0,9M và Ba(NO3)2 nồng độ C (mol/l). Thu được m gam kết tủa. Trị số của C là:
A 0,9M
B 1,1 M
C 0,8M
D 1M
Câu hỏi 22 :
Cho 20 gam hỗn hợp 3 amin đơn chức, là đồng đẳng liên tiếp của nhau tác dụng vừa đủ với dung dịch HCl, cô cạn dung dịch thu được 31,68 gam hỗn hợp muối. Biết rằng, 3 amin trên được trộn lần lượt theo tỉ lệ 1:10: 5 về số mol và thứ tự phân tử khối tăng dần. CTPT của 3 amin là
A CH3-NH2 , C2H5-NH2 , C3H7-NH2.
B C3H7NH2 , C4H9NH2,C2H5-NH2 .
C C2H5-NH2 , C3H7NH2 , C4H9NH2.
D C2H3-NH2 , C3H5-NH2 , C3H7-NH2
Câu hỏi 23 :
Cho m gam hỗn hợp gồm glyxin, alanin, valin tác dụng vừa đủ với 300ml dung dịch NaOH 1M thu được 34,7g muối khan. Giá trị m là:
A 27,8 gam.
B 28,1 gam.
C 30,22 gam
D 22,7 gam
Câu hỏi 24 :
Một cốc nước có chứa: a mol Ca2+, b mol Mg2+, c mol HCO3-, d mol Cl-, e mol SO42-. Chọn phát biểu đúng:
A Nước trong cốc là nước cứng tạm thời
B Nước trong cốc là nước cứng vĩnh cửu.
C Có biểu thức: c = 2(a +b) – (d + 2e).
D Nước trong cốc là nước cứng toàn phần, nhưng ion Ca2+ và SO42- không thể hiện diện trong cùng một dung dịch được, vì nó sẽ kết hợp tạo chất ít tan CaSO4 tách khỏi dung dịch.
Câu hỏi 25 :
Cho 0,81 gam Al và 2,8 gam Fe tác dụng với 200 ml dung dịch X chứa AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y và 8,12 gam hỗn hợp 3 kim loại. Cho 8,12 gam hỗn hợp 3 kim loại này tác dụng với dung dịch HCl dư, kết thúc phản ứng thấy thoát ra 0,672 lít H2 (đktc). Nồng độ mol của AgNO3 và Cu(NO3)2 lần lượt là
A 0,10M và 0,20M.
B 0,25M và 0,25M.
C 0,15M và 0,25M.
D 0,25M và 0,15M
Câu hỏi 26 :
Trộn 10,8 gam bột nhôm với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm thu được hỗn hợp X. hòa tan hết X bằng HCl thu được 10,752 lít H2(đktc). Hiệu suất phản ứng nhiệt nhôm và thể tích dung dịch HCl 2M cần dùng là?
A 60% và 10,8lít
B 40% và 1,08lít
C 20% và 10,8lít
D 80% và 1,08lít
Câu hỏi 27 :
Oxit B có công thức X2O. Tổng số hạt cơ bản (p, n, e) trong B là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. B là
A K2O
B Na2O
C N2O
D Cl2O
Câu hỏi 28 :
Cho 200 ml dung dịch NaOH pH = 14 vào 200 ml dung dịch H2SO4 0,25M. Thu được 400 ml dung dịch A. Trị số pH của dung dịch A bằng :
A 13,2
B 13,4
C 1,4
D 13,6
Câu hỏi 29 :
Đốt cháy hoàn toàn 1,72g hỗn hợp anđehit acrylic và một anđehit no đơn chức X hết 2,296 lít O2 (đktc). Cho toàn bộ sản phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư được 8,5g kết tủa. Xác định CTCT và khối lượng của X.
A HCHO; 0,3 gam.
B C3H5CHO; 0,70 gam
C C2H5CHO; 0,58 gam
D CH3CHO; 0,88 gam
Câu hỏi 30 :
Đốt cháy hoàn toàn hiđrocacbon X cho CO2 và H2O theo tỉ lệ mol 1,75 : 1 về thể tích. Cho bay hơi hoàn toàn 5,06 g X thu được một thể tích hơi đúng bằng thể tích của 1,76 g oxi trong cùng điều kiện. Nhận xét nào sau đây là đúng đối với X ?
A X không làm mất màu dung dịch Br2 nhưng làm mất màu dung dịch KMnO4 đun nóng .
B X tác dụng với dung dịch Br2 tạo kết tủa trắng.
C X có thể trùng hợp thành PS
D X tan tốt trong nước
Câu hỏi 31 :
Một dung dịch có chứa H2SO4 và 0,543 gam muối natri của một axit chứa oxi của clo (muối X). Cho thêm vào dung dịch này lượng KI cho đến khi iot ngừng sinh ra thì thu được 3,05 gam I2. Muối X là
A NaClO4.
B NaClO2.
C NaClO.
D NaClO3.
Câu hỏi 32 :
Cho các chất: Al, Zn, NaHCO3, Al2O3, ZnO, Zn(OH)2, CrO, Cr2O3, CrO3, Ba, Na2O, K, MgO, Fe. Số chất hòa tan được cả trong dung dịch NaOH và KHSO4 là:
A 11
B 7
C 9
D 13
Câu hỏi 33 :
Cho các dung dịch sau: dung dịch HCl, dung dịch Ca(NO3)2, dung dịch FeCl3, dung dịch AgNO3, dung dịch chứa hỗn hợp HCl và NaNO3, dung dịch chứa hỗn hợp NaHSO4 và NaNO3. Số dung dịch có thể tác dụng với đồng kim loại là:
A 4
B 2
C 3
D 5
Câu hỏi 34 :
Cho cân bằng hóa học: a A + b B D pC + q D. Ở 1050C, số mol chất D là x mol; ở 180oC, số mol chất D là y mol. Biết x > y, (a + b) > (p + q), các chất trong cân bằng trên đều ở thể khí. Kết luận nào sau đây đúng:
A Phản ứng thuận thu nhiệt và giảm áp suất.
B Phản ứng thuận tỏa nhiệt và tăng áp suất
C Phản ứng thuận thu nhiệt và tăng áp suất
D Phản ứng thuận tỏa nhiệt và giảm áp suất
Câu hỏi 35 :
Các ion nào sau không thể cùng tồn tại trong một dung dịch?
A Na+, Mg2+, NO, SO
B K+, NH4+, OH–, PO43-
C Cu2+, Fe3+, SO42- , Cl–
D Ba2+, Al3+, Cl–, HCO3-
Câu hỏi 36 :
Cho m gam hỗn hợp bột gồm Fe và Mg vào dung dịch AgNO3 dư, sau khi kết thúc phản ứng thu được 97,2 gam chất rắn. Mặt khác, cũng cho m gam hỗn hợp 2 kim loại trên vào dung dịch CuSO4 dư, sau khi kết thúc phản ứng thu được chất rắn có khối lượng 25,6 gam. Giá trị của m là
A 13,5 gam.
B 15,2 gam.
C 14,5 gam.
D 12,8 gam.
Câu hỏi 37 :
Cho 50 g hỗn hợp gồm Fe3O4, Cu , Mg tác dụng với dung dịch HCl dư ,sau phản ứng được 2,24 lít H2 (đktc) và còn lại 18 g chất rắn không tan. % Fe3O4 trong hỗn hợp ban đầu là :
A 59,2
B 25,92
C 52,9
D 46,4
Câu hỏi 38 :
Cho hỗn hợp X gồm hai hợp chất hữu cơ no, đơn chức A, B tác dụng vừa đủ với 100 ml dung dịch KOH 0,40M, thu được một muối và 336 ml hơi một ancol (ở đktc). Nếu đốt cháy hoàn toàn lượng hỗn hợp X trên, sau đó hấp thụ hết sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng 5,27 gam. Công thức của A, B là
A HCOOH và HCOOC3H7.
B HCOOH và HCOOC2H5.
C CH3COOH và CH3COOC2H5.
D C2H5COOH và C2H5COOCH3
Câu hỏi 39 :
Dung dịch D được tạo ra do hòa tan khí NO2 vào dung dịch xút có dư. Cho bột kim loại nhôm vào dung dịch D,thấy thoát ra hỗn hợp K gồm hai khí trong đó có một khí có mùi khai đặc trưng. Tỉ khối của K so với Heli bằng 2,375. Phần trăm thể tích mỗi khí trong hỗn hợp K là:
A 30%; 70%
B 35%; 65%
C 50%; 50%
D 40%; 60%
Câu hỏi 40 :
Hòa tan hoàn toàn 1 khối lượng FexOy bằng dung dịch H2SO4 đặc nóng thu được khí X và dung dịch Y. Cho khí X hấp thụ hòan toàn bởi dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác cô cạn dung dịch Y thì thu được 120 gam muối khan. Xác định FexOy
A Không xác định được
B Fe3O4
C Fe2O3
D FeO
Câu hỏi 41 :
Chọn hợp chất dùng trong hệ thống làm đông tủ lạnh đã bị cấm sử dụng
A Metyl clorua
B Clo
C Clorofom
D Freon
Câu hỏi 42 :
Ba hợp chất thơm X, Y, Z đều có công thức phân tử C7H8O. X tác dụng với Na và NaOH; Y tác dụng với Na, không tác dụng NaOH; Z không tác dụng với Na và NaOH Công thức cấu tạo của X, Y, Z lần lượt là
A C6H5CH2OH, C6H5OCH3, C6H4(CH3)OH
B C6H5OCH3, C6H5CH2OH, C6H4(CH3)OH
C C6H4(CH3)OH, C6H5OCH3, C6H5CH2OH
D C6H4(CH3)OH, C6H5CH2OH, C6H5OCH3
Câu hỏi 43 :
Thực hiện các thí nghiệm sau:Thí nghiệm 1: Trộn 0,015 mol ancol no X với 0,02 mol ancol no Y rồi cho hỗn hợp tác dụng hết với Na được 1,008 lít H2. Thí nghiệm 2: Trộn 0,02 mol ancol X với 0,015 mol ancol Y rồi cho hỗn hợp tác dụng hết với Na được 0,952 lít H2. Thí nghiệm 3: Đốt cháy hoàn toàn một lượng hỗn hợp ancol như trong thí nghiệm 1 rồi cho tất cả sản phẩm cháy đi qua bình đựng CaO mới nung, dư thấy khối lượng bình tăng thêm 6,21 gam. Biết thể tích các khi đo ở đktc. Công thức 2 ancol là
A C2H4(OH)2 và C3H6(OH)2
B C2H4(OH)2 và C3H5(OH)3
C CH3OH và C2H5OH
D Không xác định được.
Câu hỏi 44 :
Hoà tan 6,12g hỗn hợp glucozơ và saccarozơ vào nước thu được dung dịch (G). Cho G tác dụng với dung dịch AgNO3/NH3 dư thu được 3,24g Ag. Phần trăm khối lượng glucozơ trong hỗn hợp ban đầu là:
A 44,12%
B 22,05%
C 88,22%
D 11,05%
Câu hỏi 45 :
Có 5 lọ hóa chất mỗi lọ đựng một dung dịch sau ( nồng độ khoảng 0,1M) X1: NaClO4; X2: Na2S ; X3: K3PO4; X4: AlCl3 ; X5: Na2CO3 Dùng quỳ tím có thể nhận biết được dung dịch nào
A X2 và X4
B X1 và X2
C X1 và X4
D Cả 5 dung dịch.
Câu hỏi 46 :
Có các dung dịch muối riêng biệt: Al(NO3)3, Cu(NO3)2, Zn(NO3)2 , Fe(NO3)3 , AgNO3 ,Mg(NO3)2 . Nếu cho các dung dịch trên lần lượt tác dụng với dung dịch NH3 cho đến dư hoặc dung dịch NaOH cho đến dư, thì sau phản ứng số kết tủa thu được lần lượt là ?
A Đều bằng 6
B 3 và 4 .
C 6 và 3
D Đều bằng 3
Câu hỏi 47 :
Hòa tan hoàn toàn hỗn hợp gồm Zn, Cu, Fe, Cr vào dung dịch HCl có sục khí oxi thu được dung dịch X. Cho dung dịch NH3 dư vào X thu được kết tủa Y. Nung Y trong chân không hoàn toàn thu được chất rắn Z. Chất rắn Z gồm:
A CuO, FeO, CrO
B FeO, Cr2O3
C Fe2O3, Cr2O3
D Fe2O3, CrO, ZnO
Câu hỏi 48 :
Cho hỗn hợp X gồm hai amin đơn chức, no, bậc 1: X và Y. Lấy 2,28g hỗn hợp trên tác dụng hết với dung dịch HCl thì thu được 4,47g muối. Số mol của hai amin trong hỗn hợp bằng nhau. Tên của X, Y lần lượt là:
A Metylamin và isopropylamin
B Metylamin và propylamin.
C Metylamin và etylamin.
D Etylamin và propylamin.
Câu hỏi 49 :
Ôxi hóa một lượng Fe thành hỗn hợp X gồm FeO , Fe3O4 , Fe2O3 cần a mol O2 . Khử hoàn toàn hỗn hợp X thành Fe cần b mol Al. Tỷ số a : b là
A 3 : 4
B 1 : 1
C 5 : 4
D 3 : 2
Câu hỏi 50 :
Theo tổ chức Y tế thế giới, nồng độ Pb2+ tối đa trong nước sinh hoạt là 0,05 mg/l. Với kết quả phân tích các mẫu nước như sau, nguồn nước bị ô nhiễm bởi Pb2+ là mẫu
A Có 0,16 mg Pb2+ trong 4 lít
B Có 0,03 mg Pb2+ trong 0,75 lít
C Có 0,15 mg Pb2+ trong 2 lít
D Có 0,05 mg Pb2+ trong 1,25 lít
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK
