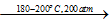Hoá học 11 Bài 12: Phân bón hóa học
Tóm tắt bài
- Phân bón hoá học: là những hóa chất có chứa các nguyên tố dinh dưỡng, được bón cho cây nhằm nâng cao năng suất mùa màng.
- Có 3 loại chính: phân đạm, phân lân và phân kali.
1.1. Phân đạm
Hình 1: Các loại đạm amoni, đạm nitrat, đạm urê
- Cung cấp N hoá hợp dưới dạng NO3-, NH4+
- Kích thích quá trình sinh trưởng, làm tăng tỉ lệ protein thực vật à Cây trồng phát triển nhanh, cho nhiều hạt, củ, quả.
- Độ dinh dưỡng được đánh giá theo tỉ lệ % khối lượng của nguyên tố N
|
Phân đạm |
amoni |
nitrat |
Urê |
|
Thành phần hoá học chính |
Muối amoni: NH4Cl; NH4NO3; (NH4)2SO4; ... |
NaNO3; Ca(NO3)2; ... |
(NH2)2CO |
|
Phương pháp điều chế |
NH3 tác dụng với axit tương ứng |
Axit nitric và muối cacbonat |
CO2+2NH3 |
|
Dạng ion hoặc hợp chất mà cây trồng đồng hoá |
NH4+; NO3- |
NO3- |
NH4+ |
1.2. Phân lân
- Cung cấp P cho cây dưới dạng ion PO4 3-
- Tăng quá trình sinh hoá, trao đổi chất, trao đổi năng lượng của cây.
- Đánh giá theo tỉ lệ % khối lượng P2O5.
|
Phân |
Supephotphat đơn |
Supephotphat kép |
Lân nung chảy |
|
Thành phần hoá học chính
Hàm lượng PO5 |
Ca(H2PO4)2 + CaSO4
14-20% |
Ca(H2PO4)2
40-50% |
Hỗn hợp phatphat và silicat của canxi, magiê
12-14% |
|
Phương pháp điều chế |
Ca3(PO4)2 + 2H2SO4 đặc → Ca(H2PO4)2 + CaSO4 |
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
4H3PO4 + Ca3(PO4)2 → 3Ca(H2PO4)2
|
Nung hỗn hợp quặng apatit, đá xà vân và than cốc ở trên 1000oC |
|
Dạng ion hoặc hợp chất mà cây trồng đồng hoá |
H2PO42- |
H2PO42- |
Không tan trong nước, tan trong môi trường axit (đất chua) |
1.3. Phân kali
- Cung cấp kali dưới dạng ion K+.
- Tăng cường tạo ra đường, bột, xơ, dầu à tăng khả năng chống rét, chống bệnh và chịu hạn cho cây.
- Đánh giá theo tỉ lệ % khối lượng K2O
1.4. Phân hỗn hợp và phân phức hợp
- Phân hỗn hợp: N,K,P
- Phức hợp: Amophot: NH4H2PO4 và (NH4)2HPO4
1.5. Phân vi lượng
- Cung cấp các nguyên tố: Bo, Mg, Zn, Cu, Mo… ở dạng hợp chất.
- Cây trồng chỉ cần 1 lượng nhỏ nên các nguyên tố trên đóng vai trò là vitamin cho thực vật.
Hình 2: Phân bón hóa học
Bài 1:
Chia dung dịch H3PO4 thành 3 phần bằng nhau:
- Trung hoà phần một vừa đủ bởi 300ml dung dịch NaOH 1,5M.
- Trộn phần hai với phần ba rồi cho tiếp vào một lượng dung dịch NaOH như đã dùng ở phần một, cô cạn dung dịch sau phản ứng thu được m gam muối. Giá trị m là:
Hướng dẫn:
\(\\ P1 : n_{NaOH}.\frac{1}{3} = n_{H_{3}PO_{4}} = 0,15 \ mol \\ P2 + P3 : n_{H_{3}PO_{4}} = 0,3 \ mol \Rightarrow n_{NaOH} = 1,5n_{H_{3}PO_{4}}\)
⇒ Tạo muối: NaH2PO4: x mol và Na2HPO4: y mol
⇒ nNaOH = x + 2y = 0,45; x + y = 0,3
⇒ x = y = 0,15 mol
⇒ Muối gồm 0,15 mol NaH2PO4 và 0,15 mol Na2HPO4
⇒ m = 39,3g
Bài 2:
Một loại phân bón không chứa tạp chất (phân nitrophotka) có chứa 17,5%N theo khối lượng. Phần trăm theo khối lượng của photpho trong loại phân bón nói trên có giá trị gần nhất với?
Hướng dẫn:
Phân Nitrophotka là: x(NH4)2HPO4.yKNO3 có %mN = 17,5%
⇒ (28x + 14y)/(132x + 101y) = 0,175
⇒ 4x = 3y
⇒ %mP = 11,625%
Bài 3:
Cho m gam NaOH vào dung dịch chứa 0,04 mol H3PO4, sau phản ứng hoàn toàn thu được dung dịch Y. cô cạn dung dịch Y thu được 1,22m gam chất rắn khan. Giá trị m là:
Hướng dẫn:
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Nếu chỉ có NaH2PO4 ⇒ mmuối =3m
Nếu chỉ có Na2HPO4 ⇒ mmuối = 1,775m
Nếu chỉ có Na3PO4 ⇒ mmuối = 1,37m
Ta thấy mNaOH < mmuối < \(m_{Na_{3}PO_{4}}\)
⇒ chất rắn gồm NaOH và Na3PO4
⇒ \(n_{Na_{3}PO_{4}}\) = 0,04 mol ⇒ nNaOH pứ = 0,12 mol
⇒ msau – mtrước = 1,22m – m = 0,04.164 – 0,12.40
⇒ m = 8 gam
3. Luyện tập Bài 12 Hóa học 11
Sau bài học cần nắm:
- Nhận biết một số phân bón hóa học
- Sử dụng an toàn, hiệu quả một số phân bón hoá học.
- Tính khối lượng phân bón cần thiết để cung cấp một lượng nguyên tố dinh dưỡng.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 12 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Ca(H2PO4)2 và CaSO4
- B. Ca3(PO4)2
- C. NH4H2PO4
- D. Ca(H2PO4)2
-
- A. (NH4)2HPO4 và KNO3.
- B. (NH4)2HPO4 và NH4H2PO4.
- C. NH4H2PO4 và KNO3.
- D. (NH4)3PO4 và KNO3.
-
- A. Dung dịch H2SO4.
- B. Dung dịch Ca(OH)2.
- C. Dung dịch AgNO3.
- D. Dung dịch HCl.
-
- A. 1.
- B. 2.
- C. 3.
- D. 4.
-
- A. 2.
- B. 3.
- C. 4.
- D. 1.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 12.
Bài tập 12.2 trang 19 SBT Hóa học 11
Bài tập 12.3 trang 19 SBT Hóa học 11
Bài tập 12.1 trang 19 SBT Hóa học 11
Bài tập 12.4 trang 19 SBT Hóa học 11
Bài tập 12.5 trang 19 SBT Hóa học 11
Bài tập 12.6 trang 19 SBT Hóa học 11
Bài tập 12.7 trang 19 SBT Hóa học 11
Bài tập 1 trang 70 SGK Hóa học 11 nâng cao
Bài tập 2 trang 70 SGK Hóa học 11 nâng cao
Bài tập 3 trang 70 SGK Hóa học 11 nâng cao
Bài tập 4 trang 70 SGK Hóa học 11 nâng cao
Bài tập 5 trang 70 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 12 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK