Hoá học 11 Bài 8: Amoniac và muối amoni
Tóm tắt bài
1.1. AMONIAC
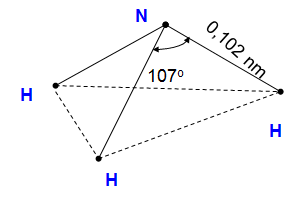
1.1.1. Cấu tạo phân tử
Hình 1: Sơ đồ cấu tạo của phân tử NH3
- Nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực.
- Nguyên tử N còn có 1 cặp e hoá trị.
- Nguyên tử N có số oxi hóa thấp nhất -3
- Phân tử có cấu tạo không đối xứng nên phân tử NH3 phân cực.
1.1.2. Tính chất vật lý
- Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
- Tan nhiều trong nước, tạo thành dd có tính kiềm
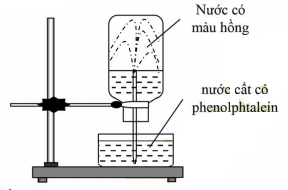
Video 1: Sự hòa tan của Amoniac trong nước
- Khí NH3 tan nhiều trong nước làm giảm P trong bình và nước bị hút vào bình. Phenolphtalein chuyển thành màu hồng ⇒ NH3 có tính bazơ.
-
Dung dịch NH3 đậm đặc trong phòng thí nghiệm có nồng độ 25% (N = 0,91g/cm3).
1.1.3. Tính chất hóa học
Tính bazơ yếu
Tác dụng với nước
- Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dd bazơ ⇒ dd NH3 là bazơ yếu:
NH3 + H2O \(\rightleftharpoons\) NH4++ OH-
- Làm quỳ tím chuyển sang màu xanh
Tác dụng với dung dịch bazơ
- Dung dịch NH3 có khả năng làm kết tủa nhiều hidroxít kim loại
AlCl3 + 3NH3 + 3 H2O → Al(OH)3 \(\downarrow\) + 3 NH4Cl
Al3++3NH3+3H2O → Al(OH)3 \(\downarrow\) + 3NH4+
Tác dụng với axít
2NH3 + H2SO4 → (NH4)2SO4
NH3 (k) + HCl (k) → NH4Cl
(không màu) (ko màu) (khói trắng)
Video 2: Amoniac tác dụng với axit clohidric
Tính khử
Trong phân tử NH3, N có số oxi hóa là -3. Nitơ có các số oxi hóa là -3,0,+1,+2,+3,+4,+5. Như vậy trong các phản ứng hóa học khi có sự thay đổi số oxi hóa, số oxi hóa của N trong NH3 chỉ có thể tăng lên → thể hiện tính khử.
Tác dụng với oxi
Video 3: Thí nghiệm giữa NH3 và Oxi
NH3 được tạo ra từ phản ứng của NH4Cl và CaO
Khí O2 được tạo ra từ phản ứng của KClO3 và MnO2
- Hiện tượng: Que đóm đang cháy bỗng vụt tắt
- Giải thích: Khí N2 không duy trì sự cháy 4 NH3 + 3O2
2N2 + 6 H2O
Tác dụng với Clo
2NH3 + 3Cl2 → N2 + 6 HCl
Nếu NH3 dư : NH3 + HCl → NH4Cl (khói trắng)
* Kết luận: Amoniac có các tính chất hoá học cơ bản: Tính bazơ yếu và Tính khử
1.1.4. Ứng dụng
- Sản xuất HNO3
- Sản xuất phân đạm và dd NH3 có thể sử dụng trực tiếp làm phân bón
- Điều chế N2H4 làm nhiên liệu cho tên lửa
- NH3 lỏng dùng làm chất làm lạnh cho thiết bị lạnh
- Sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản nông phẩm...)
- Sử dụng trong công nghiệp môi trường (loại bỏ một số khí gây ô nhiễm như SO2...)
1.1.5. Điều chế
Trong phòng thí nghiệm
- Đun nóng muối amoni với Ca(OH)2 hay dd kiềm: 2NH4Cl+Ca(OH)2 → CaCl2+2NH3 \(\uparrow\)+2H2O
- Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
- Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
Trong công nghiệp
N2 + 3H2 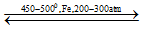
- Nhiệt độ: 450 – 500OC
- Áp suất: 200- 300 atm
- Chất xúc tác: Fe/Al2O3, K2O
1.2. MUỐI AMONI
Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít. Ví dụ: NH4Cl, (NH4)2SO4 , (NH4)2CO3
1.2.1.Tính chất vật lý
- Tinh thể
- Đều tan trong nước
- Ion NH4+ không màu
1.2.2.Tính chất hoá học
Tác dụng với bazơ kiềm
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
Phương trình ion thu gọn: NH4+ + OH- → NH3 + H2O → Điều chế NH3 trong Phòng thí nghiệm và nhận biết muối amoni.
Phản ứng nhiệt phân
- Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3
NH4Cl (r) .PNG)
(NH4)2CO3 (r) .PNG)
NH4HCO3(r) .PNG)
- (NH4)2CO3; NH4HCO3 ở nhiệt độ thường cũng tự phân huỷ; ở nhiệt độ cao phản ứng xảy ra nhanh hơn; Dùng NH4HCO3 trong bột nở.
- Muối amoni tạo bởi axít có tính oxi hoá: (HNO2, HNO3) → N2 , N2O
NH4NO2 .PNG)
NH4NO3 .PNG)
Bài 1:
Để nhận biết các dung dịch: NH4NO3, (NH4)2SO4, K2SO4 đựng trong các lọ mất nhãn ta dùng:
Hướng dẫn:
- Bước 1: Trích dẫn 3 mẫu thử
- Bước 2: Bari tan trong nước tạo dung dịch Ba(OH)2
- NH4NO3: có khí mùi khai: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3\(\uparrow\) + 2H2O
- (NH4)2SO4: khí mùi khai và kết tủa trắng: Ba(OH)2 + (NH4)2SO4 → BaSO4\(\downarrow\) + 2NH3\(\uparrow\) + 2H2O
- K2SO4: kết tủa trắng: Ba(OH)2 + K2SO4: → BaSO4 \(\downarrow\)+ 2KOH
Bài 2:
Hỗn hợp X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác) thu được hỗn hợp Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là:
Hướng dẫn:
MX = 7,2. Áp dụng quy tắc đường chéo ta có: \(n_{H_2}:n_{N_2}=4:1\)
⇒ Giả sử ban đầu có 4 mol H2 và 1 mol N2 trong X
N2 + 3H2 ↔ 2NH3
x → x → 2x
⇒ sau phản ứng: nY = 2x + (1 - x) + (4 - 3x) = 5 - 2x mol
Bảo toàn khối lượng: mX = mY
⇒ 5 × 7,2 = (5 - 2x) × 2 × 4
⇒ x = 0,25 mol
⇒ H% (tính theo N2) = 25%
Bài 3:
Cho các phản ứng sau:
4NH3 + 5O2 → 4NO + 6H2O (1)
NH3 + H2SO4 → NH4HSO4 (2)
2NH3 + 3CuO → 3Cu + N2\(\uparrow\) + 3H2O (3)
8NH3 + 3Cl2 → N2 + 6NH4Cl (4)
NH3 + H2S → NH4HS (5)
2NH3 + 3O2 → 2N2\(\uparrow\) + 6H2O (6)
NH3 + HCl → NH4Cl (7)
Số phản ứng trong đó NH3 không đóng vai trò là chất khử là:
Hướng dẫn:
Các phản ứng mà có sự tăng số oxi hóa của N ⇒ NH3 thể hiện tính khử. Các phản ứng không có hiện tượng trên là: 2, 5, 7.
3. Luyện tập Bài 8 Hóa học 11
Sau bài học cần nắm:
- Cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, amoniac trong phòng thí nghiệm và trong công nghiệp.
- Tính chất hoá học của amoniac: Tính bazơ yếu (tác dụng với nước, dung dịch muối, axit) và tính khử (tác dụng với oxi, clo).
- Cách điều chế NH3. Tính chất vật lí (trạng thái, màu sắc, tính tan).
- Tính chất hoá học (phản ứng với dung dịch kiềm, phản ứng nhiệt phân) và ứng dụng của muối amoni.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 8 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. SO2.
- B. Cl2.
- C. CH4.
- D. NH3.
-
- A. NaNO3.
- B. NH4NO3.
- C. AgNO3.
- D. Cu(NO3)2.
-
- A. NaOH.
- B. Ba(OH)2.
- C. BaCl2.
- D. AgNO3.
-
- A. NH3, NH4+, OH-.
- B. NH3, H2O.
- C. NH4+, OH-.
- D. NH4+, OH-, H2O, NH3.
-
- A. Tính tan nhiều trong nước của NH3.
- B. Tính tan nhiều trong nước của HCl.
- C. Tính axit của HCl.
- D. Tính bazo của NH3.
-
- A. NH4Cl.
- B. NH3.
- C. N2.
- D. HNO3.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 8.
Bài tập 8.9 trang 13 SBT Hóa học 11
Bài tập 8.10 trang 13 SBT Hóa học 11
Bài tập 8.11 trang 13 SBT Hóa học 11
Bài tập 8.12 trang 13 SBT Hóa học 11
Bài tập 1 trang 47 SGK Hóa học 11 nâng cao
Bài tập 2 trang 47 SGK Hóa học 11 nâng cao
Bài tập 3 trang 47 SGK Hóa học 11 nâng cao
Bài tập 4 trang 47 SGK Hóa học 11 nâng cao
Bài tập 5 trang 47 SGK Hóa học 11 nâng cao
Bài tập 6 trang 47 SGK Hóa học 11 nâng cao
Bài tập 7 trang 48 SGK Hóa học 11 nâng cao
Bài tập 8 trang 48 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 8 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK