Đề thi Hóa học 11 Giữa kì 1 có đáp án !!
Câu hỏi 3 :
Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. .
B. .
C..
D.
Câu hỏi 4 :
Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 0,5M và 0,5M vào 100 ml dung dịch X chứa hỗn hợp gồm 1,5M và 1M, thu được V lít khí (ở đktc). Giá trị của V là
A. 1,12.
B. 2,24.
C. 3,36.
D. 4,48.
Câu hỏi 6 :
Chất X là muối khi tan trong nước tạo ra dung dịch có môi trường axit. Khi cho X tác dụng với dung dịch dư hay dung dịch KOH dư đều thu được kết tủa (sau khi phản ứng xảy ra hoàn toàn). X là
A.
B. .
C. .
D. .
Câu hỏi 8 :
Một dung dịch có thì dung dịch đó có môi trường
A. axit.
B. bazơ.
C. trung tính.
D. không xác định được.
Câu hỏi 9 :
Dung dịch X gồm 0,15 mol ; 0,3 mol ; 0,25 mol ; a mol và b mol . Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
A. 0,4.
B. 0,3.
C. 0,2.
D. 0,5.
Câu hỏi 11 :
Trong số các chất sau: . Số chất thuộc loại chất điện li yếu là
A. 7.
B. 5.
C. 6.
D. 4.
Câu hỏi 12 :
Trộn 100 ml dung dịch NaOH có pH = 11 với 50 ml dung dịch KOH có pH = 12 thu được dung dịch X. Nồng độ ion OH trong dung dịch X là
A. M.
B. M.
C. M.
D. M.
Câu hỏi 13 :
Khi thêm một ít dung dịch HCl vào dung dịch thì nồng độ ion trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. Tăng.
B. Giảm.
C. Không đổi.
D. Tăng sau đó giảm.
Câu hỏi 14 :
Cho 0,266 lít dung dịch X gồm NaOH 0,5M và 0,25M vào 140 ml dung dịch 0,3 M thu được m gam kết tủa. Giá trị của m là
A. 5,46.
B. 20,9545.
C. 34,818.
D. 15,4945.
Câu hỏi 16 :
Cho từ từ dung dịch vào lượng dư dung dịch thì
A. có sủi bọt khí , có kết tủa trắng , trong dung dịch có .
B. có sủi bọt khí , có kết tủa trắng và , trong dung dịch có .
C. có sủi bọt khí , có kết tủa trắng , trong dung dịch có .
D. có sủi bọt khí , có kết tủa trắng và , trong dung dịch có .
Câu hỏi 17 :
Cho 100ml dung dịch X chứa KOH 0,13M và 0,1M tác dụng với 200ml dung dịch x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
A. 0,03.
B. 0,09.
C. 0,06.
D. 0,045.
Câu hỏi 18 :
Dung dịch nào sau đây không dẫn điện?
A. Dung dịch HCl trong nước.
B. Dung dịch glucozơ trong nước.
C. Dung dịch NaCl trong nước.
D. Dung dịch NaOH trong nước.
Câu hỏi 19 :
Trong dung dịch có tất cả bao nhiêu anion (bỏ qua sự phân li của nước)?
A. 1.
B. 2.
C. 3.
D. 4.
Câu hỏi 20 :
Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Axit axetic là axit nhiều nấc.
B. Một hợp chất trong thành phần phân tử có hiđro là axit.
C. Bazơ là chất khi tan trong nước phân li ra ion .
D. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
Câu hỏi 21 :
Có 500 ml dung dịch X chứa . Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí . Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tổng khối lượng muối có trong 300 ml dung dịch X là
A. 71,4 gam.
B. 23,8 gam.
C. 86,2 gam.
D. 119 gam.
Câu hỏi 23 :
Một dung dịch có chứa các ion: (0,1 mol), (0,15 mol), (0,1 mol), và (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Câu hỏi 24 :
Cho từ từ z mol khí vào hỗn hợp A gồm x mol NaOH và y mol thấy kết tủa xuất hiện, tăng dần đến cực đại và tan đi một phần. Sau phản ứng, thu được m gam kết tủa. Giá trị của m là
A. 197(x + 2y - z).
B. 197(x + y - z).
C. 197(z - x - 2y).
D. 197(2z - x - y).
Câu hỏi 25 :
Cho các phản ứng sau:
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Câu hỏi 27 :
Cho hỗn hợp gồm Na và Ba tan hoàn toàn trong nước thu được dung dịch X và 1,008 lít khí (ở đktc). Thể tích dung dịch chứa HCl 1M và 1M cần dùng để trung hòa X là
A. 60ml.
B. 15ml.
C. 45ml.
D. 30ml.
Câu hỏi 28 :
Cho 2 phương trình ion rút gọn:
A. Tính khử:.
B. Tính khử: .
C. Tính oxi hóa: .
D. Tính oxi hóa: .
Câu hỏi 30 :
Cho các dung dịch có cùng nồng độ 0,01M: . Thứ tự giảm dần giá trị pH của các dung dịch đó là
A. (2), (4), (3), (1).
B. (1), (3), (4), (2).
C. (1), (3), (2), (4).
D. (2), (3), (4), (1).
Câu hỏi 31 :
Hòa tan m gam hỗn hợp X gồm hai muối vào nước thu được dung dịch chứa 0,05 mol ; 0,1 mol ; 0,2 mol và x mol . Giá trị của m là
A. 29,85.
B. 23,7.
C. 16,6.
D. 13,05.
Câu hỏi 32 :
Cho 4 dung dịch loãng, có cùng nồng độ mol: . Dung dịch có pH nhỏ nhất và lớn nhất lần lượt là
A. HCl và .
B. và .
C. HCl và .
D. và .
Câu hỏi 33 :
Dung dịch X chứa 0,07 mol ; a mol ; 0,12 mol và 0,02 mol . Cho 120 ml dung dịch hỗn hợp KOH 1,2M và 0,1M vào X, sau khi các phản ứng kết thúc, thu được m gam kết tủa. Giá trị của m là
A. 5,835.
B. 5,055.
C. 4,275.
D. 4,512.
Câu hỏi 34 :
Dung dịch nào sau đây không dẫn điện?
A. Dung dịch NaCl trong nước.
B. Dung dịch trong nước.
C. Dung dịch KCl trong nước.
D. Dung dịch trong nước.
Câu hỏi 35 :
Cho 4,48 lít vào 150 ml dung dịch 1M, cô cạn hỗn hợp các chất sau phản ứng ta thu được chất rắn có khối lượng là
A. 18,1 gam.
B. 15 gam.
C. 8,4 gam.
D. 20 gam.
Câu hỏi 36 :
Hỗn hợp X gồm và . Cho 2,91 gam X tác dụng với dung dịch dư thu được 5,285 gam kết tủa. Cho 2,91 gam X tác dụng với dung dịch KOH dư, thì số mol KOH đã phản ứng là
A. 0,030 mol.
B. 0,015 mol.
C. 0,020 mol.
D. 0,025 mol.
Câu hỏi 39 :
Phản ứng trao đổi ion trong dung dịch các chất điện li thực chất là phản ứng giữa các
A. nguyên tử.
B. ion.
C. tinh thể.
D. phân tử.
Câu hỏi 40 :
Dung dịch nào sau đây có môi trường kiềm?
A. Dung dịch có .
B. Dung dịch có .
C. Dung dịch có .
D. Dung dịch có .
Câu hỏi 41 :
Thí nghiệm nào sau đây có sinh ra chất khí nhưng không sinh ra chất kết tủa?
A. Cho dung dịch vào dung dịch .
B. Cho dung dịch vào dung dịch .
C. Cho dung dịch vào dung dịch .
D. Cho dung dịch HCl vào dung dịch .
Câu hỏi 43 :
Dung dịch nào sau đây làm quỳ tím hóa đỏ?
A. Dung dịch có pH = 8.
B. Dung dịch có pH = 10.
C. Dung dịch có pH = 4.
D. Dung dịch có pH = 7.
Câu hỏi 44 :
Cho từ từ 65 ml dung dịch HCl 1,6M vào 70 ml dung dịch 0,8M, sau khi các phản ứng kết thúc thu được V lít khí (đktc). Giá trị của V là
A. 0,2668.
B. 0,9408.
C. 1,0752.
D. 0,8064.
Câu hỏi 47 :
Cho từ từ đến hết 140 ml dung dịch NaOH 0,6M vào 90 ml dung dịch 0,3M. Khối lượng kết tủa thu được là
A. 0,936 gam.
B. 1,560 gam.
C. 1,872 gam.
D. 1,404 gam.
Câu hỏi 48 :
Phản ứng xảy ra trong dung dịch giữa cặp chất nào sau đây là phản ứng trao đổi ion?
A. .
B. .
C. đặc.
D. Fe + HCl.
Câu hỏi 50 :
Có 4 dung dịch: NaOH, NaCl, đều có nồng độ 0,1M. Dung dịch có tổng nồng độ mol của các ion nhỏ nhất là
A. NaCl.
B. NaOH.
C. .
D. .
Câu hỏi 51 :
Hòa tan một ít tinh thể vào dung dịch thì nồng độ trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. tăng.
B. tăng sau đó giảm.
C. không đổi.
D. giảm.
Câu hỏi 52 :
thể hiện tính khử khi tác dụng với chất X và thể hiện tính bazơ khi tác dụng với chất Y. Các chất X, Y tương ứng là
A. , HCl.
B. HCl, .
C. .
D. .
Câu hỏi 55 :
Trộn 80 ml dung dịch HCl 0,03M với 50 ml dung dịch 0,02M thu được dung dịch có pH = x. Giá trị của x gần nhất với giá trị nào sau đây?
A. 1,6.
B. 1,5.
C. 2,0.
D. 1,8.
Câu hỏi 56 :
Cho 150 ml dung dịch 0,1M vào 30 ml dung dịch hỗn hợp NaOH 0,2M và 0,1M, sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 0,699.
B. 1,287.
C. 4,083.
D. 2,169.
Câu hỏi 57 :
Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Axit càng nhiều H thì càng mạnh.
C. Bazơ mạnh là bazơ nhiều nấc.
D. Bazơ là chất khi tan trong nước phân li ra anion .
Câu hỏi 58 :
Trộn ba dung dịch: HCl 0,2M; 0,1M và 0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH = x. Giá trị của x là
A. 4.
B. 1.
C. 2.
D. 3.
Câu hỏi 60 :
Cặp chất nào sau đây vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH?
A. .
B. .
C. .
D. .
Câu hỏi 66 :
Giả sử dung dịch các chất sau: đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. .
C. NaOH.
D. KCl.
Câu hỏi 67 :
Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu hỏi 68 :
Một dung dịch có . Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu hỏi 69 :
Đối với dung dịch axit mạnh 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. .
B. .
C. .
D. .
Câu hỏi 72 :
Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. .
C. .
D. NaCl.
Câu hỏi 73 :
Chọn phát biểu không đúng khi nói về .
A. là muối axit.
B. dung dịch có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu hỏi 74 :
Cho K dư vào dung dịch chứa . Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu hỏi 76 :
Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. .
B. .
C. .
D. .
Câu hỏi 82 :
Trộn hai thể tích bằng nhau của dung dịch và dung dịch NaOH có cùng nồng độ mol/l. Giá trị pH của dung dịch sau phản ứng là
A. pH = 2.
B. pH = 7.
C. pH > 7.
D. pH < 7.
Câu hỏi 83 :
Đối với dung dịch axit yếu 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. .
B. .
C. .
D. .
Câu hỏi 84 :
Cho 5g NaCl vào dung dịch chứa 8,5g thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu hỏi 86 :
Theo A-rê-ni-ut, axit là
A. chất khi tan trong nước phân li ra anion .
B. chất khi tan trong nước phân li ra cation .
C. chất khi tan trong nước phân li ra anion .
D. Tất cả đều sai.
Câu hỏi 87 :
Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu hỏi 89 :
Ở , tích số được gọi là
A. tích số tan của nước.
B. tích số phân li của nước.
C. độ điện li của nước.
D. tích số ion của nước.
Câu hỏi 90 :
Cụm từ nào sau đây còn thiếu trong dấu “…” ở câu sau: “Các dung dịch axit, bazơ, muối dẫn điện được là do trong dung dịch của chúng có các … chuyển động tự do”.
A. electron.
B. phân tử.
C. ion.
D. nguyên tử.
Câu hỏi 91 :
Phương trình ion rút gọn của phản ứng cho biết:
A. Không tồn tại phân tử trong dung dịch các chất điện li.
B. Nồng độ các trong dung dịch.
C. Các ion tồn tại trong dung dịch.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Câu hỏi 93 :
Chất nào sau đây không dẫn được điện?
A. NaCl nóng chảy.
B. nóng chảy.
C. HBr hoà tan trong .
D. NaCl rắn, khan.
Câu hỏi 95 :
Muối axit là
A. Muối tạo bởi bazơ yếu và axit mạnh.
B. Muối vẫn còn hiđro có khả năng phân li ra cation .
C. Muối vẫn còn hiđro trong phân tử.
D. Muối có khả năng phản ứng với bazơ.
Câu hỏi 100 :
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p53s2.
B. 1s22s22p63s1.
C. 1s22s22p63s2.
D. 1s22s22p43s1.
Câu hỏi 101 :
Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. phi kim.
B. kim loại.
C. khí trơ.
D. kim loại hoặc phi kim.
Câu hỏi 102 :
Hợp chất nào sau đây ở dạng tinh thể, dễ tan trong nước và có nhiệt độ nóng chảy cao?
A. NaCl.
B. H2O.
C. HCl.
D. NH3.
Câu hỏi 103 :
Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
A. AgNO3+ NaCl → AgCl + NaNO3.
B. NaOH + HCl → NaCl + H2O.
C. 2Na + 2H2O → 2NaOH + H2.
D. 2 NaHCO3→ Na2CO3+ CO2+ H2O.
Câu hỏi 104 :
Cho phương trình phản ứng a Al + bHNO3→ c Al(NO3)3+ d N2O + e H2O. Tỉ lệ (a : e) là
A. 4: 1.
B. 1: 4.
C. 15: 8.
D. 8: 15.
Câu hỏi 105 :
Nitơ trong hợp chất nào sau đây vừa có tính oxi hoá vừa có tính khử?
A. NaNO3.
B. NaNO2.
C. HNO3.
D. NH3.
Câu hỏi 106 :
Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu đỏ?
A. HCl.
B. NaOH.
C. NaCl.
D. NaNO3.
Câu hỏi 107 :
Ozon là một dạng thù hình quan trọng của oxi. Trong tự nhiên có 1 lớp ozon mỏng hình thành ở tầng bình lưu, cách mặt đất khoảng 15-35 km – tùy địa điểm, nó có tác dụng ngăn các bức xạ nguy hại như tia cực tím, tia vũ trụ, bảo vệ các sinh vật trên Trái Đất. Hình ảnh bên dưới mô phỏng cho lỗ hổng tầng ozon. Em hãy cho biết công thức phân tử của ozon là
A.O3.
B. O2.
C. O4.
D. H2O2.
Câu hỏi 108 :
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
A. NH3.
B. CO2.
C. SO2.
D. H2S.
Câu hỏi 109 :
Thực hiện thí nghiệm như hình vẽ mô phỏng dưới đây. Em hãy cho biết, chất lỏng trong bình (c) có thể là chất nào sau đây?
A. dung dịchmuối ăn.
B. dung dịch saccarozơ.
C. dung dịch ancol etylic.
D. nước cất.
Câu hỏi 114 :
Sau khi nhúng lần lượt từng giấy chỉ thị pH (có sự chuyển màu tương tự như quỳ tím) vào 4 cốc, mỗi cốc chứa 1 chất lỏng được đánh số như trên giấy chỉ thị. Khẳng định nào sau đây là đúng?
A.Cốc 1 chứa dung dịch NaOH.
B. Cốc 2 chứa nước cất.
C. Cốc 3 chứa dung dịch HCl.
D. Cốc 4 chứa axit axetic.
Câu hỏi 115 :
A. NaHCO3+ NaOH → Na2CO3+ H2O.
A. NaHCO3+ NaOH → Na2CO3+ H2O.
B. KOH + HCl → KCl+ H2O.
C. Ba(OH)2+ H2SO4→ BaSO4+ 2H2O.
D. Cu(OH)2+ 2HCl → CuCl2+ 2H2O.
Câu hỏi 117 :
A. Al3+, PO43–, Cl–, Ba2+.
A. Al3+, PO43–, Cl–, Ba2+.
B. Ca2+, Cl–, Na+, CO32–.
C. K+, Ba2+, OH–, Cl–.
D. Na+, K+, OH–, HCO3–.
Câu hỏi 118 :
A. (3), (2), (4), (1).
A. (3), (2), (4), (1).
B. (4), (1), (2), (3).
C. (1), (2), (3), (4).
D. (2), (3), (4), (1).
Câu hỏi 119 :
Hình ảnh bên dưới là sản phẩm một loại phân bón trên thị trường. Em hãy cho biết, nó được xếp vào loại nào sau đây
A.phân đạm.
B. Phân tổng hợp.
C. Phân phức hợp.
D. Phân vi lượng.
Câu hỏi 125 :
Trong phòng thí nghiệm, người ta thường thu khí bằng một trong ba cách như trong hình vẽ. Hãy cho biết khí nitơ có thể được thu bằng cách nào?
A.Cách 1 hoặc cách 3.
B. Cách 1 hoặc cách 2.
C. Cách 2 hoặc cách 3.
D. Cả ba cách.
Câu hỏi 126 :
A. tính bazơ yếu và tính khử.
A. tính bazơ yếu và tính khử.
B. tính axit yếu và tính khử.
C. tính bazơ yếu và tính oxi hóa.
D. tính axit yếu và tính oxi hóa.
Câu hỏi 128 :
Hình vẽ mô phỏng thí nghiệm dưới đây nhằm chứng minh điều gì?
A.Tính oxi hóa rất mạnh của photpho đỏ.
B. Tính khử rất mạnh của photpho trắng.
C. Photpho trắng kém bền với nhiệt hơn photpho đỏ.
D. Khả năng phản ứng của photpho với kim loại sắt.
Câu hỏi 132 :
Trộn 500 ml dung dịch chứa hỗn hợp HNO3 0,08M và H2SO4 0,01M với 500 ml dung dịch KOH x M thu được 1 lít dung dịch có pH bằng 12. Giá trị của x là
A. 0,13M.
B. 0,12M.
C. 0,14M.
D. 0.10M.
Câu hỏi 133 :
A. CO32−và 33,29.
A. CO32−và 33,29.
B. SO42−và 44,81.
C. CO32−và 23,69.
D. SO42−và 29,45.
Câu hỏi 134 :
A. KH2PO4và K2HPO4.
A. KH2PO4và K2HPO4.
B. KH2PO4và K3PO4.
C. K3PO4và K2HPO4.
D. K3PO4và KOH dư.
Câu hỏi 136 :
Hoà tan hoàn toàn 16,1 gam hỗn hợp gồm Na, K và Ca vào nước, thu được dung dịch X và 6,72 lít khí H2(đktc). Dung dịch Y gồm HNO3và H2SO4,tỉ lệ mol tương ứng là 2: 5. Trung hoà dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là
A. 46,9 gam.
B. 30,2 gam.
C. 46,3 gam.
D. 41,2 gam.
Câu hỏi 140 :
A. phân li hòan toàn thành ion.
A. phân li hòan toàn thành ion.
B. phân li một phần ra ion.
C. tạo dung dịch dẫn điện tốt.
D. phân li ra ion.
Câu hỏi 141 :
Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do
A. nitơ có độ âm điện lớn nhất trong nhóm.
B. phân tử nitơ có liên kết ba khá bền.
C. nitơ có bán kính nguyên tử nhỏ.
D. phân tử nitơ không phân cực.
Câu hỏi 142 :
Cho phản ứng: Cu + HNO3loãng Cu(NO3)2+ NO + H2O. Tổng hệ số các chất (số nguyên tối giản nhất) trong phương trình trên là
Cu(NO3)2+ NO + H2O. Tổng hệ số các chất (số nguyên tối giản nhất) trong phương trình trên là
A. 16.
B. 10.
C. 20.
D. 12.
Câu hỏi 144 :
Cho dãy các chất: (NH4)2SO4, NaCl, ZnCl2, FeCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2tạo thành kết tủa là
A. 3.
B. 4.
C. 2.
D. 1.
Câu hỏi 145 :
Kim loại nào sau đây bị thụ động trong axit HNO3 đặc, nguội?
A. Cu.
B. Al.
C. Zn.
D. Pb.
Câu hỏi 146 :
A. X có tính bazơ yếu hơn Y.
A. X có tính bazơ yếu hơn Y.
B. Tính bazơ của X bằng Y.
C. X có tính bazơ mạnh hơn Y.
D. X có tính axit yếu hơn Y.
Câu hỏi 148 :
A. chuyển sang màu đỏ.
A. chuyển sang màu đỏ.
B. mất màu.
C. chuyển sang màu xanh.
D. không chuyển màu.
Câu hỏi 151 :
A. CaCO3, Fe(OH)3, FeO.
A. CaCO3, Fe(OH)3, FeO.
B. CuO, NaOH, FeCO3.
C. KOH, FeS, Cu(OH)2.
D. Fe(OH)3, Na2CO3, Fe2O3.
Câu hỏi 152 :
A. H2SO4+ BaCl2→ BaSO4+ 2HCl.
A. H2SO4+ BaCl2→ BaSO4+ 2HCl.
B. NaOH + NaHCO3→ Na2CO3+ H2O.
C. 3HCl + Fe(OH)3→ FeCl3+ 3H2O.
D. H2SO4+ 2KOH → K2SO4+ 2H2O.
Câu hỏi 154 :
A. tổng hợp amoniac.
A. tổng hợp amoniac.
B. làm môi trường trơ.
C. tổng hợp phân đạm.
D. sản xuất axit nitric.
Câu hỏi 155 :
Muối axit là muối
A. tạo bởi axit mạnh và bazơ mạnh .
B. tạo bởi axit yếu và bazơ yếu.
C. mà anion gốc axit không còn nguyên tử hiđro có khả năng phân li ra ion H+.
D. mà anion gốc axit vẫn còn nguyên tử hiđro có khả năng phân li ra ion H+.
Câu hỏi 156 :
A. những ion nào tồn tại trong dung dịch.
A. những ion nào tồn tại trong dung dịch.
B. nồng độ những ion nào trong dung dịch là lớn nhất.
C. không tồn tại phân tử trong dung dịch chất điện li.
D. bản chất của phản ứng trong dung dịch các chất điện li.
Câu hỏi 158 :
A. N2+ 6Li  2Li3N.
2Li3N.
A. N2+ 6Li  2Li3N.
2Li3N.
B. N2+ O2 2NO. .
2NO. .
C. N2+ 3Mg  Mg3N2.
Mg3N2.
D. N2+ 3H2⇄ 2NH3.
Câu hỏi 159 :
A. Ca2+, Cl-, Na+, CO32-.
A. Ca2+, Cl-, Na+, CO32-.
B. Na+, OH-, HCO3-, Mg2+.
C. Al3+, SO42-, Cl-, Ba2+.
D. K+, Ba2+, OH-, Cl-.
Câu hỏi 163 :
Chọn phát biểu đúng trong số các phát biểu sau đây?
A. Giá trị pH tăng thì độ axit giảm.
B. Giá trị pH tăng thì độ axit tăng.
C. Dung dịch có pH < 7 làm quỳ tím hoá xanh.
D. Dung dịch có pH >7 làm quỳ tím hoá đỏ.
Câu hỏi 165 :
Chất nào sau đây tác dụng với HCl dư tạo ra chất khí?
A.Ba(OH)2.
B.Na2CO3.
C.K2SO4.
D.Ca(NO3)2.
Câu hỏi 166 :
Dung dịch nào sau đây không dẫn được điện?
A.Dung dịch NaCl.
B.Nước cất.
C.Dung dịch NaOH.
D.Dung dịch HCl.
Câu hỏi 167 :
Phương pháp dùng để điều chế N2 trong phòng thí nghiệm?
A. Nhiệt phân muối amoni nitrit.
B. Phân hủy amoniac bằng tia lửa điện
C. Cho Zn tác dụng với HNO3 rất loãng
D. Đốt cháy NH3 trong oxi dư rồi ngưng tụ nước.
Câu hỏi 169 :
Một oxit nitơ có CTPT dạng NxOytrong đó nitơ chiếm 30,43% về khối lượng. Oxit đó có công thức là
A.NO
B.N2O
C.NO2
D.N2O5
Câu hỏi 170 :
Đối với dung dịch axit mạnh HNO30,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A.[H+] = 0,10M.
B.[H+] < [NO3-].
C.[H+] >[NO3-].
D.[H+] < 0,10M.
Câu hỏi 171 :
Cho dung dịch Ba(HCO3)2lần lượt vào các dung dịch sau: HNO3, Na2SO4, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
A.1.
B.2.
C.3.
D.4.
Câu hỏi 172 :
Dãy các chất đều tác dụng được với dung dịch Ba(HCO3)2là
A.HNO3, NaCl, và Na2SO4.
B.NaCl, Na2SO4và Ca(OH)2.
C.HNO3, Ca(OH)2và KNO3.
D.HNO3, Ca(OH)2và Na2SO4.
Câu hỏi 173 :
Dung dịch của một bazơ ở 25oC có
A. [H+] = 1,0.10-7M.
B. [H+] < 1,0.10-7M.
C. [H+] >1,0.10-7M.
D. [H+].[OH-] >1,0.10-14.
Câu hỏi 174 :
Cho 2 lít N2và 7 lít H2vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 8,2 lít (thể tích các khí đo ở cùng điều kiện). Hiệu suất phản ứng là
A.50%.
B.30 %.
C.20 %.
D.40 %.
Câu hỏi 175 :
A.NH3+ HCl → NH4Cl.
A.NH3+ HCl → NH4Cl.
B.2NH3+ H2SO4→ (NH4)2SO4
C.2NH3+ 3CuO  N2+ 3Cu + 3H2O.
N2+ 3Cu + 3H2O.
D.3NH3+ 3H2O + AlCl3→ Al(OH)3↓ + 3NH4Cl.
Câu hỏi 176 :
Một mẫu nước có pH = 3,82 thì nồng độ mol /l của ion H+trong đó là
A. [H+] = 1,0.10-3M.
B. [H+] = 1,0.10-4M.
C. [H+] >1,0.10-4M.
D. [H+] < 1,0.10-4M.
Câu hỏi 177 :
Cặp chất nào sau đây tồn tại trong cùng một dung dịch?
A.NaOH và MgSO4.
B.NaCl và Al(NO3)3.
C. K2CO3 và HNO3.
D. NH4Cl và NaOH.
Câu hỏi 180 :
Đối với dung dịch axit HNO20,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A.[H+] = 0,10M.
B.[H+] < [NO2-].
C.[H+] >[NO2-].
D.[H+] < 0,10M.
Câu hỏi 181 :
A.8NH3+ 3Cl2 N2+ 6NH4Cl.
N2+ 6NH4Cl.
A.8NH3+ 3Cl2 N2+ 6NH4Cl.
N2+ 6NH4Cl.
B.2NH3+ H2SO4→ (NH4)2SO4
C.2NH3+ 3CuO  N2+ 3Cu + 3H2O.
N2+ 3Cu + 3H2O.
D.4NH3+ 3O2 2N2+ 6H2O.
2N2+ 6H2O.
Câu hỏi 183 :
Người ta tiến hành thí nghiệm cho từ từ dung dịch chứa 2 gam Ca(NO3)2vào một dung dịch chứa 2 gam Na2CO3. Sau khoảng 5 phút tiếp tục nhỏ từ từ dung dịch HCl loãng dư vào, hiện tượng quan sát được là
A.Kết tủa trắng và khí bay ra.
B. Có khí bay ra và có kết tủa trắng.
C. Chỉ có kết tủa trắng.
D. Chỉ có khí bay ra.
Câu hỏi 184 :
Một phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành.
A.Chất kết tủa.
B. Chất điện li yếu.
C. Chất khí
D. Chất kết tủa hoặc chất khí hoặc chất điện li yếu.
Câu hỏi 189 :
A.Những ion nào tồn tại trong dung dịch.
A.Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C.Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu hỏi 190 :
Một dung dịch có pH = 9. Cho biết màu của phenolphtalein trong dung dịch này.
A.Màu cam.
B. Màu đỏ.
C.Màu hồng.
D.Không màu.
Câu hỏi 191 :
Trộn 200 ml dd HCl 0,005 M với 100 ml NaOH 0,01 M và KOH 0,03 M được 300 ml dung dịch. Giá trị pH của dung dịch tạo thành sau khi trộn là?
A.12
B. 13
C.1
D. 2
Câu hỏi 193 :
Khi nhúng mẩu giấy quỳ tím vào dung dịch nước chanh có giá trị pH khoảng 2,4 thì quỳ chuyển màu . . ., nếu nhúng mẩu giấy quỳ vào dung dịch amoniac có giá trị pH = 9,8 thì quỳ chuyển màu . . .
A. Đỏ-Hồng
B. Đỏ-Xanh
C.Tím-Xanh
D. Vàng nhạt-Đỏ
Câu hỏi 195 :
Cho phản ứng hóa học FeS + 2X FeCl2+ H2S. Chất X trong phản ứng là .
A. HCl
B. FeS
Z. FeCl3
D. H2S
Câu hỏi 196 :
Cho dung dịch NaOH dư vào 150 ml dung dịch (NH4)2SO41M, đun nóng nhẹ. Sau phản ứng hoàn toàn thu được V lít khí thoát ra ở đktc.
A.2,24
B.4,48
C.6,72
D.1,12
Câu hỏi 197 :
Dung dịch A chứa các ion: Fe2+(0,05 mol), Al3+(0,1 mol), Cl- (. . .mol), SO42-(. . .mol). Cô cạn dung dịch A thu được 23,45 g muối khan.
A.0,1 và 0,15
B. 0,1 và 0,1
C. 0,15 và 0,05
D.0,05 và 0,1
Câu hỏi 198 :
Cho từ từ 200 ml dung dịch hỗn hợp HCl 1M và H2SO40,5M vào 300 ml dd Na2CO31M thu được . . .lít khí (ở đktc).
A. 4,48
B.1,12
C.2,24
D.5,12
Câu hỏi 199 :
Cho hỗn hợp X gồm 0,05 mol CaCl2; 0,03 mol KHCO3; 0,05 mol NaHCO3; 0,04 mol K2O; 0,03 mol Ba(NO3)2vào 437,57 gam H2O, sau khi phản ứng xảy ra hoàn toàn thu được . . .gam kết tủa và . . .gam dung dịch Y.
A.212
B.397
C.324
D.451
Câu hỏi 200 :
Cấu hình electron nguyên tử của nitơ là
A.1s22s22p63s23p2.
B.1s22s22p5.
C.1s22s22p1.
D.1s22s22p3.
Câu hỏi 201 :
Phát biểu nào sau đây đúng?
A.NH3là chất khử mạnh.
B.NH3có tính khử mạnh, tính oxi hóa yếu.
C. NH3có tính oxi hóa mạnh, tính khử yếu.
D.NH3là chất oxi hóa mạnh.
Câu hỏi 204 :
Khí amoniac không có tính chất vật lí nào sau đây?
A.Nặng hơn không khí.
B.Không màu.
C.Mùi khai, xốc.
D. Tan rất nhiều trong nước.
Câu hỏi 205 :
Sự điện li là
A.sự hòa tan một chất vào nước tạo ra dung dịch.
B.sự phân li một chất dưới tác dụng của dòng điện.
C.quá trình oxi hóa khử.
D.sự phân li một chất thành ion dương và ion âm khi chất đó tan trong nước.
Câu hỏi 206 :
Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là
A.Al3+, Ba2+, SO42-, Cl-.
B.Cu2+, K+, OH-, NO3-.
C.Ca2+, Na+, Cl-, CO32-.
D.K+, Ba2+, OH-, NO3-.
Câu hỏi 207 :
Môi trường kiềm là môi trường trong đó
A.[H+]>1,0.10-7M.
B.[H+] = [OH-].
C.[H+] < [OH-].
D.[H+] >[OH-].
Câu hỏi 208 :
Phản ứng nào sau đây N2thể hiện tính khử?
A. N2+ 3Ca 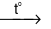 Ca3N2.
Ca3N2.
B. N2+ 6Li → 2Li3N.
C. N2+ O2 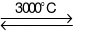 2NO.
2NO.
D. N2+ 3H2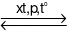 2NH3.
2NH3.
Câu hỏi 210 :
Theo thuyết A-rê-ni-ut, chất nào sau đây là axit?
A. H2SO4.
B. NaCl.
C. CH3COONa.
D. KOH.
Câu hỏi 212 :
Khí nitơ tương đối trơ ở nhiệt độ thường là do
A. phân tử nitơ có một liên kết cộng hóa trị không cực.
B. nguyên tố nitơ có độ âm điện lớn nhất trong nhóm VA.
C. phân tử nitơ có liên kết ba bền.
D. nguyên tố nitơ có bán kính nguyên tử nhỏ.
Câu hỏi 213 :
Dung dịch X có pH = 3. Dung dịch X có môi trường
A. trung tính.
B. kiềm.
C. không xác định được.
D. axit.
Câu hỏi 214 :
Chất nào sau đây là hiđroxit lưỡng tính?
A. Al(OH)3.
B. Fe(OH)3.
C. Mg(OH)2.
D. Ca(OH)2.
Câu hỏi 215 :
Cho dung dịch KOH dư vào 50 ml dung dịch (NH4)2SO41M. Đun nóng nhẹ, thu được V lít khí NH3thoát ra (đktc). Giá trị của V là
A. 2,24.
B. 3,36.
C. 1,12.
D. 4,48.
Câu hỏi 216 :
Phương trình ion thu gọn H++ OH-→ H2O biểu diễn bản chất của phản ứng hoá học nào sau đây?
A. KCl + AgNO3 → AgCl + KNO3.
B. H2SO4+ BaCl2 → BaSO4+ 2HCl.
C. 2HNO3+ CaO → Ca(NO3)2+ H2O.
D. HCl + NaOH → NaCl + H2O.
Câu hỏi 217 :
Muối nào sau đây khi bị nhiệt phân tạo thành khí NH3?
A. NH4NO3.
B. NH4NO2.
C. NaCl.
D. NH4Cl.
Câu hỏi 218 :
Dãy các chất nào sau đây đều là chất điện li?
A. H2SO4, MgCl2, NaOH.
B. CO2, C2H5OH, NaOH.
C. C2H5OH, H2SO4, MgCl2.
D. C12H22O11, H2SO4, CO2.
Câu hỏi 219 :
Để điều chế 6 lít NH3từ N2và H2với hiệu suất 40% thì thể tích khí N2(lít) cần dùng ở cùng điều kiện là bao nhiêu?
A. 7,5.
B. 15,0.
C. 16,5.
D. 24,0.
Câu hỏi 220 :
Phương trình ion rút gọn của phản ứng cho biết
A. những ion nào tồn tại trong dung dịch.
B. bản chất của phản ứng trong dung dịch các chất điện li.
C. không tồn tại phân tử trong dung dịch các chất điện li.
D. nồng độ những ion nào trong dung dịch lớn nhất.
Câu hỏi 221 :
Chất nào sau đây là hiđroxit lưỡng tính?
A. Ba(OH)2.
B. Fe(OH)3.
C. Mg(OH)2.
D. Zn(OH)2.
A. 4,48.
B. 2,24.
Câu hỏi 222 :
Dung dịch X có pH = 12. Dung dịch X có môi trường
A. kiềm.
B. trung tính.
C. không xác định được.
D. axit.
A. 4,48.
B. 2,24.
Câu hỏi 223 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
A. chất điện li mạnh, chất kết tủa, chất khí.
B. chất điện li yếu, chất kết tủa, chất khí.
C. chất điện li mạnh, chất dễ tan, chất khí.
D. chất điện li yếu, chất dễ tan, chất khí.
A. 4,48.
B. 2,24.
Câu hỏi 224 :
Tính chất hóa học của NH3là
A. tính bazơ mạnh, tính oxi hóa yếu.
B. tính bazơ mạnh, tính khử yếu.
C. tính khử mạnh, tính bazơ yếu.
D. tính bazơ yếu, tính oxi hóa mạnh.
A. 4,48.
B. 2,24.
Câu hỏi 225 :
Axit nào sau đây là axit 2 nấc?
A. H3PO4.
B. HNO3.
C. H2SO4.
D. HCl.
A. 4,48.
B. 2,24.
Câu hỏi 226 :
Theo thuyết A-rê-ni-ut, chất nào sau đây là bazơ?
A. H2SO4.
B. NH4NO3.
C. LiCl.
D. NaOH.
A. 4,48.
B. 2,24.
Câu hỏi 228 :
Ở điều kiện thường, amoniac là chất
A. khí, màu nâu, mùi xốc.
B. lỏng, màu nâu, mùi khai.
C. khí, không màu, mùi khai.
D. lỏng, không màu, mùi xốc.
A. 4,48.
B. 2,24.
Câu hỏi 229 :
Phương trình ion thu gọn H++ OH-→ H2O biểu diễn bản chất của phản ứng hoá học nào sau đây?
A. H2SO4+ BaCl2 → BaSO4+ 2HCl.
B. HNO3+ KOH → KNO3+ H2O.
C. KCl + AgNO3 → AgCl + KNO3.
D. CO2+ 2NaOH → Na2CO3+ H2O.
A. 4,48.
B. 2,24.
Câu hỏi 230 :
Để điều chế 6 lít NH3từ N2và H2với hiệu suất 25% thì thể tích khí N2(lít) cần dùng ở cùng điều kiện là bao nhiêu?
A. 7,5.
B. 24,0.
C. 12,0.
D. 15,0.
A. 4,48.
B. 2,24.
Câu hỏi 231 :
Nitơ thể hiện tính oxi hóa khi tác dụng với dãy các chất nào sau đây?
A. H2, O2.
B. Mg, O2.
C. Mg, H2.
D. Ca, O2.
A. 4,48.
B. 2,24.
Câu hỏi 232 :
Giá trị pH của 75 ml dung dịch chứa 0,3 gam NaOH là
A. 12,0.
B. 2,0.
C. 13,0.
D. 1,0.
A. 4,48.
B. 2,24.
Câu hỏi 233 :
Muối amoni nào khi bị nhiệt phân không tạo thành khí NH3?
A. NH4Cl.
B. NH4HCO3.
C. (NH4)2CO3.
D. NH4NO3.
A. 4,48.
B. 2,24.
Câu hỏi 234 :
Chất điện li là chất tan trong nước
A. phân li hoàn toàn ra ion.
B. phân li một phần ra ion.
C. tạo dung dịch dẫn điện tốt.
D. phân li ra ion.
A. 4,48.
B. 2,24.
Câu hỏi 235 :
Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là
A. Cu2+, Ag+, Cl-, CO32-.
B. Al3+, Ba2+, SO42-, Cl-.
C. Na+, K+, OH-, SO42-.
D. K+, Ca2+, OH-, CO32-.
A. 4,48.
B. 2,24.
Câu hỏi 236 :
Nitơ phản ứng được với dãy các chất nào sau đây để tạo ra các hợp chất khí?
A. O2, Ba.
B. H2, O2.
C. Na, K.
D. H2, Ca.
A. 4,48.
B. 2,24.
Câu hỏi 237 :
Môi trường axit là môi trường trong đó
A. [H+] >[OH-].
B. [H+] < [OH-].
C. [H+] = [OH-].
D. [H+]< 1,0.10-7M.
A. 4,48.
B. 2,24.
Câu hỏi 238 :
Chất nào sau đây là muối axit?
A. Ba(OH)2.
B. Al(NO3)3.
C. NaHSO4.
D. HCl.
A. 4,48.
B. 2,24.
Câu hỏi 239 :
Vị trí của nitơ trong bảng hệ thống tuần hoàn là
A. ô 7, chu kỳ 2, nhóm VA.
B. ô 14, chu kỳ 2, nhóm VA.
C. ô 7, chu kỳ 3, nhóm IIIA.
D. ô 14, chu kỳ 3, nhóm IIIA.
A. 4,48.
B. 2,24.
Câu hỏi 240 :
Cho dung dịch KOH dư vào 100 ml dung dịch (NH4)2SO41M. Đun nóng nhẹ, thu được V lít khí NH3thoát ra (đktc). Giá trị của V là
C. 3,36.
Câu hỏi 241 :
Thêm 250 ml dung dịch KOH 1M vào 110 ml dung dịch H3PO41M. Các chất thu được trong dung dịch là
A.KH2PO4 và K3PO4.
B.K2HPO4 và K3PO4.
C.K2HPO4 và KH2PO4.
D.K3PO4và KOH dư.
Câu hỏi 242 :
Nhận định nào sau đây không đúng?
A.H3PO4vừa có tính khử vừa có tính oxi hóa.
B. Dùng AgNO3để phát hiện ion photphat trong dung dịch muối.
C.H3PO4tác dụng với NaOH có khả năng cho đồng thời 3 muối.
D.P2O5là anhiđrit của H3PO4.
Câu hỏi 243 :
Trộn 40ml dung dịch H2SO40,25M với 60ml dung dịch NaOH 0,5M. Giá trị pH của dung dịch sau khi trộn là
A.14.
B.12.
C.13.
D.11.
Câu hỏi 244 :
Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là:
A. Chỉ có kết tủa keo trắng.
B.Không có kết tủa, có khí bay lên.
C. Có kết tủa keo trắng, sau đó kết tủa tan.
D.Có kết tủa keo trắng và có khí bay lên.
Câu hỏi 245 :
Cho m gam Cu tác dụng hoàn toàn với dung dịch HNO3loãng, dư thu 6,72 lít khí NO (là sản phẩm khử duy nhất). Giá trị của m là:
A.19,2 gam.
B.28,8 gam.
C.14,4 gam.
D.12,8 gam.
Câu hỏi 246 :
Khí đinitơ oxit còn có tên gọi là “khí cười” vì khi hít phải một lượng nhỏ khí này thì có cảm giác say và hay cười. Trong y học đinitơ oxit được dùng để gây mê trong một số ca tiểu phẫu. Công thức phân tử của đinitơ oxit là
A.N2O.
B.NO2.
C.NO.
D.N2O4.
Câu hỏi 247 :
Hòa tan hết 4,431 gam hh kim loại gồm Al và Mg trong dd HNO3loãng thu được dd A và 1,568 lít hh khí X đều không màu, có khối lượng 2,59 gam, trong đó có một khí bị hóa nâu trong không khí (không có NH4NO3). Cho dung dịch NaOH (dư) vào X và đun nóng, không có khí mùi khai thoát ra. Vậy % theo khối lượng của mỗi kim loại trong hh bằng:
A.12% và 88%.
B.13% và 87%.
C.12,8% và 87,2%.
D.20% và 80%.
Câu hỏi 248 :
Dung dịch nào sau đây có khả năng dẫn điện ?
A.Dung dịch đường glucozơ.
B. Dung dịch benzen trong rượu.
C.Dung dịch rượu.
D.Giấm ăn.
Câu hỏi 250 :
Khối lượng kết tủa thu được khi trộn 20 ml dung dịch AgNO31M và 10 ml dung dịch CaCl21M là:
A.2,87 gam.
B.3,94 gam.
C.4,39 gam.
D.1,435 gam.
Câu hỏi 251 :
Trong phản ứng: Fe + HNO3Fe(NO3)3+ NO + H2O. Hệ số cân bằng tối giản của HNO3là:
A. 6.
B. 4.
C. 8.
D. 2.
Câu hỏi 252 :
Trong dung dịch axit H3PO4loãng (bỏ qua sự phân li của H2O) có những ion nào?
A. H+, PO43-, H3PO4.
B. H+, PO43-, H2O.
C. H+, H2PO4- , HPO42- , PO43-, HPO4, H2O.
Câu hỏi 253 :
Các dung dịch: NaCl, NaOH, Al2(SO4)3, Ba(OH)2có cùng nồng độ mol, dung dịch dẫn điện tốt nhất là:
A. Al2(SO4)3.
B. Ba(OH)2.
C. NaOH.
D. NaCl.
Câu hỏi 254 :
Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là muối nitrit và oxi
A. Mg(NO3)2.
B. NH4NO3.
C. AgNO3.
D. KNO3.
Câu hỏi 255 :
Kết luận nào đúng khi nói về nitơ (N2)
A. N2duy trì sự sống, sự cháy.
B. N2nặng hơn CO2
C. N2tan nhiều trong nước.
D. N2được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu hỏi 257 :
Dung dịch AlCl30,1M có nồng độ cation Al3+ là bao nhiêu?
A. 0,1M.
B. 0,15M.
C. 0,2M.
D. 0,3M.
Câu hỏi 258 :
Tro thực vật cũng là một loại phân kali vì nó chứa:
A. KNO3.
B. K2CO3.
C. KCl.
D. K2O.
Câu hỏi 259 :
Cho dung dịch HCl dư vào 150 ml dung dịch K2CO31M. Đun nóng nhẹ, thể tích khí thu được (đktc) là bao nhiêu?
A. 33,60 lít.
B. 3,36 lít.
C. 7,62 lít.
D. 6,72 lít.
Câu hỏi 260 :
Phản ứng nào dưới đây có phương trình ion rút gọn là: H++ OH- → H2O
A. Ba(OH)2+ H2SO4 → BaSO4 + H2O.
B. CH3COOH + NaOH → CH3COONa + H2O.
C. Ca(OH)2+ 2HNO3→ Ca(NO3)2+ 2H2O.
D. KOH + KHCO3→ Na2CO3 + H2O.
Câu hỏi 261 :
Chất điện li là chất khi tan trong nước
A. phân li hoàn toàn thành ion.
B. phân li một phần ra ion.
C. tạo dung dịch dẫn điện tốt.
D. phân li ra ion.
Câu hỏi 262 :
Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do
A. nitơ có độ âm điện lớn nhất trong nhóm.
B. phân tử nitơ có liên kết ba khá bền.
C. nitơ có bán kính nguyên tử nhỏ.
D. phân tử nitơ không phân cực.
Câu hỏi 263 :
Cho phản ứng: Cu + HNO3loãng Cu(NO3)2+ NO + H2O. Tổng hệ số các chất (số nguyên tối giản nhất) trong phương trình trên là
Cu(NO3)2+ NO + H2O. Tổng hệ số các chất (số nguyên tối giản nhất) trong phương trình trên là
A. 16.
B. 10.
C. 20.
D. 12.
Câu hỏi 266 :
Một dung dịch có nồng độ [H+] = 3,0. 10-12M. Dung dịch có môi trường
A. trung tính.
B. bazơ.
C. lưỡng tính.
D. axit.
Câu hỏi 268 :
A. chuyển sang màu đỏ.
A. chuyển sang màu đỏ.
B. mất màu.
C. chuyển sang màu xanh.
D. không chuyển màu.
Câu hỏi 269 :
A. X có tính bazơ yếu hơn Y.
A. X có tính bazơ yếu hơn Y.
B. Tính bazơ của X bằng Y.
C. X có tính bazơ mạnh hơn Y.
D. X có tính axit yếu hơn Y.
Câu hỏi 272 :
A. CaCO3, Fe(OH)3, FeO.
A. CaCO3, Fe(OH)3, FeO.
B. CuO, NaOH, FeCO3.
C. KOH, FeS, Cu(OH)2.
D. Fe(OH)3, Na2CO3, Fe2O3.
Câu hỏi 273 :
A. H2SO4+ BaCl2→ BaSO4+ 2HCl.
A. H2SO4+ BaCl2→ BaSO4+ 2HCl.
B. NaOH + NaHCO3→ Na2CO3+ H2O.
C. 3HCl + Fe(OH)3→ FeCl3+ 3H2O.
D. H2SO4+ 2KOH → K2SO4+ 2H2O.
Câu hỏi 275 :
A. tổng hợp amoniac.
A. tổng hợp amoniac.
B. làm môi trường trơ.
C. tổng hợp phân đạm.
D. sản xuất axit nitric.
Câu hỏi 276 :
Muối axit là muối
A. tạo bởi axit mạnh và bazơ mạnh .
B. tạo bởi axit yếu và bazơ yếu.
C. mà anion gốc axit không còn nguyên tử hiđro có khả năng phân li ra ion H+.
D. mà anion gốc axit vẫn còn nguyên tử hiđro có khả năng phân li ra ion H+.
Câu hỏi 277 :
A. những ion nào tồn tại trong dung dịch.
A. những ion nào tồn tại trong dung dịch.
B. nồng độ những ion nào trong dung dịch là lớn nhất.
C. không tồn tại phân tử trong dung dịch chất điện li.
D. bản chất của phản ứng trong dung dịch các chất điện li.
Câu hỏi 279 :
A. N2+ 6Li  2Li3N.
2Li3N.
A. N2+ 6Li  2Li3N.
2Li3N.
B. N2+ O2 2NO. .
2NO. .
C. N2+ 3Mg  Mg3N2.
Mg3N2.
D. N2+ 3H2⇄ 2NH3.
Câu hỏi 280 :
Nhóm ion nào sau đây tồn tại trong cùng một dung dịch?
A. Ca2+, Cl-, Na+, CO32-.
B. Na+, OH-, HCO3-, Mg2+.
C. Al3+, SO42-, Cl-, Ba2+.
D. K+, Ba2+, OH-, Cl-.
Câu hỏi 283 :
Chất nào sau đây là chất điện li yếu?
C. H2SO3
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 284 :
N2thể hiện tính khử trong phản ứng với
C. Mg.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 285 :
Chất nào sau đây là axit theo Areniut?
C. NaCl.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 286 :
HNO3 không thể hiện tính oxi hóa mạnh khi phản ứng với chất nào sau đây?
C. FeO.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 287 :
Nhúng quỳ tím vào dung dịch chứa chất nào sau đây, quỳ chuyển sang màu đỏ?
C. NaCl.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 288 :
Chất nào dưới đây vừa tác dụng với dung dịch HCl, vừa tác dụng với NaOH?
C. NaHCO3.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 289 :
Kim loại không phản ứng trong dung dịch HNO3đặc, nguội là
C. Cu.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 290 :
Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
C. (NH4)3PO4.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 291 :
Ở cùng điều kiện về nhiệt độ, áp suất và nồng độ, dung dịch nào sau đây dẫn điện tốt nhất?
C. CH3COOH.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 292 :
Phản ứng chỉ có phương trình ion rút gọn: 2H++ S2- → H2S là:
C. FeS( r) + 2HCl → 2H2S + FeCl2.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 293 :
Nguyên tố nitơ có số oxi hóa trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O lần lượt là
C. +2, +4, -3, -5, +1.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 294 :
Dãy các muối amoni khi bị nhiệt phân đều tạo khí NH3là:
C. NH4Cl, NH4NO3, NH4NO2.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 295 :
Dãy gồm các ion nào sau đây không cùng tồn tại trong một dung dịch?
C. NH4+, OH-, Fe3+, Cl-.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 296 :
Dung dịch A có a mol NH4+, b mol Mg2+, c mol SO42-, d mol HCO3-. Biểu thức nào biểu thị sự liên quan giữa a, b, c, d?
C. a + 2b = 2c + d.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 297 :
Phát biểu nào sau đây là đúng?
C. Khi tác dụng với kim loại hoạt động nitơ thể hiện tính khử.
A. KCl.
B. HNO3.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 298 :
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là
B. Nước phun vào bình và không có màu.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 299 :
Cho 2,8 gam N2, tác dụng với 0,8 gam H2, biết hiệu suất phản ứng đạt 20%. Thể tích khí NH3thu được sau phản ứng (đktc) là
C. 0,672 lít.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
Câu hỏi 300 :
Cho dung dịch KOH đến dự vào 50 ml (NH4)2SO41M, đun nóng nhẹ. Sau phản ứng thu được thể tích khí thoát ra (đktc) là
C. 4,48 lít.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 301 :
Trộn 70ml dung dịch HCl 0,12M với 30ml dung dịch Ba(OH)20,10M thu được dung dịch A. pH của dung dịch A là
C. 1,26.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 302 :
Phát biểu nào sau đây là đúng?
A. Giá trị pH tăng thì độ axit giảm.
C. Dung dịch có pH < 7 làm quỳ tím hoá xanh.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 303 :
Cho các phát biểu sau:
C. 3.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 304 :
Hòa tan hết hỗn hợp 3 kim loại Al, Zn, Mg trong dung dịch HNO3loãng vừa đủ, thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X, thu được m gam muối khan (trong đó O chiếm 61,364% về khối lượng). Nung m gam muối khan nói trên với khối lượng không đối, thu được 19,2 gam chất rắn. Giá trị của m gần nhất giá trị nào sau đây?
C. 75.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 305 :
Cho dung dịch các chất: Ca(HCO3)2, NaOH, (NH4)2CO3, KHSO4, BaCl2 . Ở điều kiện thường khi trộn từng cặp 2 chất với nhau. Số cặp chất xảy ra phản ứng là
C. 8.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Câu hỏi 306 :
Hòa tan hoàn toàn 3,76 gam hỗn hợp X gồm S, FeS và FeS2trong dung dịch HNO3, đặc nóng, dư thu được 0,48 mol NO2(là sản phẩm khử duy nhất) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2dư, lọc và nung kết tủa đến khối lượng không đổi được m gam hỗn hợp rắn Z. Giá trị của m là
C. 15,145.
A. KCl.
B. HNO3.
A. Nitơ không duy trì sự cháy, sự hô hấp và là một khí độc.
B. Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học.
A. Fe(OH)2.
B. Fe3O4.
A. Fe(NO2)3..
B. Na2CO3.
A. HCl.
B. KNO3.
A. 0,896 lít.
B. 1,120 lít.
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK
