Hoá học 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
Tóm tắt bài
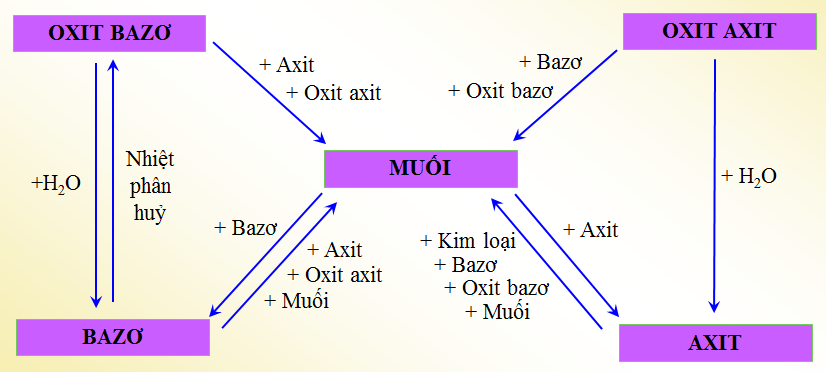
1.1. Mối quan hệ giữa các loại chất vô cơ
Hình 1: Mối quan hệ giữa các loại chất vô cơ
1.2. Những phản ứng hoá học minh họa
1. CaO +2 HCl → CuCl2 +H2O
2. CO2 + 2NaOH → Na2CO3 + H2O
3. K2O + H2O → 2KOH
4. Cu(OH)2 → CuO + H2O
5. SO3 + H2O → H2SO4
6. Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
7. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
8. AgNO3 + HCl → AgCl + HNO3
9. H2SO4 + ZnO → ZnSO4 + H2O
* Lưu ý:
- Một số oxit kim loại như Al2O3, MgO, BaO, CaO, Na2O, K2O … không bị H2, CO khử.
- Các oxit kim loại khi ở trạng thái hoá trị cao là oxit axit như: CrO3, Mn2O7,…
- Các phản ứng hoá học xảy ra phải tuân theo các điều kiện của từng phản ứng.
- Khi oxit axit tác dụng với dd Kiềm thì tuỳ theo tỉ lệ số mol sẽ tạo ra muối axit hay muối trung hoà.
NaOH + CO2 →NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
- Khi tác dụng với H2SO4 đặc, kim loại sẽ thể hiện hoá trị cao nhất, không giải phóng Hidro
Cu + 2H2SO4 → CuSO4 + SO2 + H2SO4
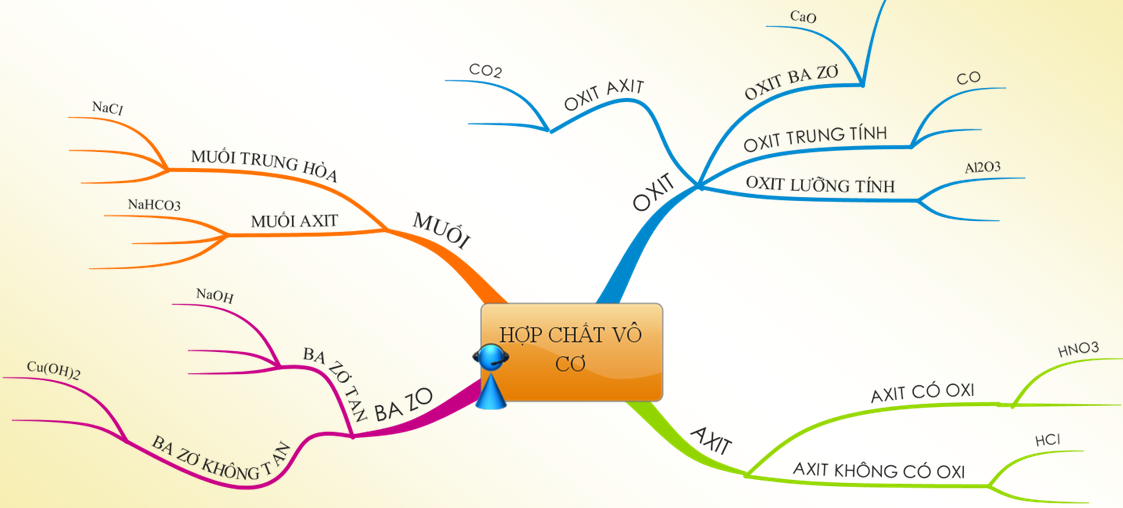
1.3. Tổng kết
Hình 2: Sơ đồ tư duy về Mối quan hệ giữa các hợp chất vô cơ
Bài 1:
Hoàn thành chuỗi phương trình phản ứng sau:
Fe → FeCl2 → Fe(NO3)2 → Fe(OH)2 → FeO
Hướng dẫn:
\(\begin{array}{l} \left( {\rm{1}} \right){\rm{ Fe + 2HCl}} \to {\rm{FeC}}{{\rm{l}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}\\ \left( {\rm{2}} \right){\rm{ FeC}}{{\rm{l}}_{\rm{2}}}{\rm{ + 2AgN}}{{\rm{O}}_{\rm{3}}} \to {\rm{Fe}}{\left( {{\rm{N}}{{\rm{O}}_{\rm{3}}}} \right)_{\rm{2}}}{\rm{ + 2AgCl}}\\ \left( {\rm{3}} \right){\rm{ Fe}}{\left( {{\rm{N}}{{\rm{O}}_{\rm{3}}}} \right)_{\rm{2}}}{\rm{ + 2NaOH}} \to {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ + 2NaN}}{{\rm{O}}_{\rm{3}}}\\ \left( {\rm{4}} \right){\rm{ Fe}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}({t^0}) \to {\rm{FeO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \end{array}\)
Bài 2:
Ngâm một lá đồng vào dung dịch AgNO3 20%. Sau phản ứng, thu được dung dịch đồng (II) sunfat (CuSO4) và 10,8 gam Ag. Biết AgNO3 phản ứng hết.
a) Viết phương trình phản ứng
b) Tính khối lượng dung dịch AgNO3 20% đã tham gia phản ứng.
Hướng dẫn:
Số mol của Ag là: \({n_{Ag}} = \frac{m}{M} = \frac{{10,8}}{{108}} = 0,1(mol)\)
a) Phương trình phản ứng:
AgNO3 + Cu → CuSO4 + Ag
0,1 \(\leftarrow\) 0,1
b) Khối lượng dung dịch AgNO3 20% đã tham gia phản ứng là:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100 \Rightarrow {m_{dd}} = \frac{{{m_{ct}}.100}}{{C\% }} = \frac{{0,1 \times 170 \times 100}}{{20}} = 85(gam)\)
3. Luyện tập Bài 12 Hóa học 9
Sau bài học cần nắm:
- Oxit, Axit, Bazơ và Muối loại hợp chất này có sự chuyển đổi qua lại với nhau như thế nào?
- Và điều kiện cho sự chuyển đổi đó là gì?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 12 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Dung dịch Ca(OH)2
- B. Dung dịch Na2SO4
- C. Nước
- D. Dung dịch H2SO4
-
- A. Cho khí oxi đi qua dung dịch KCl
- B. Cho khí oxi đi qua dung dịch Ca(OH)2
- C. Cho khí oxi đi qua dung dịch HCl
- D. Cả 3 phương pháp trên đều đúng
-
- A. Na2O ; SO3 ; Ca(OH)2 ; H2SO4
- B. Na2O ; SO2 ; Ca(OH)2 ; H2SO4
- C. Na2O ; SO2 ; CaO ; H2SO4
- D. Na2O ; SO3 ; Ca(OH)2 ; H2SO3
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 12.
Bài tập 1 trang 41 SGK Hóa học 9
Bài tập 2 trang 41 SGK Hóa học 9
Bài tập 3 trang 41 SGK Hóa học 9
Bài tập 4 trang 41 SGK Hóa học 9
Bài tập 12.1 trang 15 SBT Hóa học 9
Bài tập 12.2 trang 16 SBT Hóa học 9
Bài tập 12.3 trang 16 SBT Hóa học 9
Bài tập 12.4 trang 17 SBT Hóa học 9
Bài tập 12.5 trang 17 SBT Hóa học 9
Bài tập 12.6 trang 17 SBT Hóa học 9
Bài tập 12.7 trang 17 SBT Hóa học 9
Bài tập 12.8 trang 17 SBT Hóa học 9
4. Hỏi đáp về Bài 12 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK