Hoá học 9 Bài 8: Một số bazơ quan trọng
Tóm tắt bài
1.1. Natri Hiđroxit
1.1.1. Tính chất vật lí

Hình 1: Trạng thái tự nhiên của NaOH
- NaOH là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn làm bục vải, giấy và ăn mòn da.
1.1.2. Tính chất hóa học
NaOH là bazơ tan và có các tính chất hóa học của một bazơ tan:
- Làm đổi màu chất chỉ thị ( phenolphtalein, quì tím ).
- Tác dụng với axit.
- Tác dụng với oxit axit.
- Tác dụng với dung dịch muối.
a. Đổi màu chất chỉ thị
Dung dịch NaOH làm quì tím chuyển sang màu xanh, phenolphtalein không màu thành màu đỏ.
Video 1: Dung dịch NaOH tác dụng với giấy quỳ và phenolphtalein
b. Tác dụng với axit
- Các em chú ý cách tiến hành thí nghiệm:
- Ban đầu, người ta cho vào cốc dung dịch NaOH và nhỏ vài giọt dung dịch phenol phtalein. Trong môi trường bazơ, quỳ hóa hồng.
- Sau đó, cho thêm vào cốc dung dịch HCl trung hòa bazơ trong cốc, đến khi bazơ hết thì dung dịch mất màu hồng. Do trong môi trường trung tính hay axit thì dung dịch phenolphtalein đều không có màu.
Video 2: Phản ứng giữa dung dịch NaOH và HCl
- Phản ứng hóa học: NaOH + HCl → NaCl + H2O
- Ví dụ khác:
- NaOH + HCl → NaCl + H2O
- NaOH + HNO3 → NaNO3 + H2O
- Kết luận: Dung dịch NaOH tác dụng với axit tạo thành muối và nước.
c. Tác dụng với oxit axit
- Một số phương trình phản ứng:
-
2NaOH + CO2 → Na2CO3 + H2O
-
NaOH + CO2 → NaHCO3
-
2NaOH + SO2 → Na2SO3 + H2O
-
- Kết luận: Dung dịch NaOH tác dụng với oxit axit tạo thành muối và nước.
d.Tác dụng với dung dịch muối
(Sẽ được trình bày cụ thể ở bài 9)
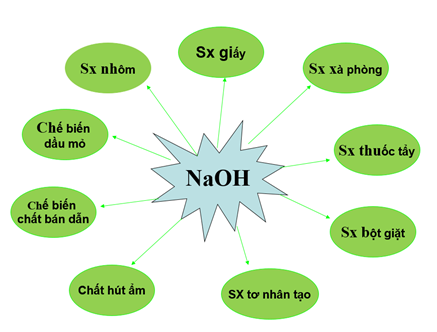
1.1.3. Ứng dụng của NaOH
Hình 2: Ứng dụng của NaOH
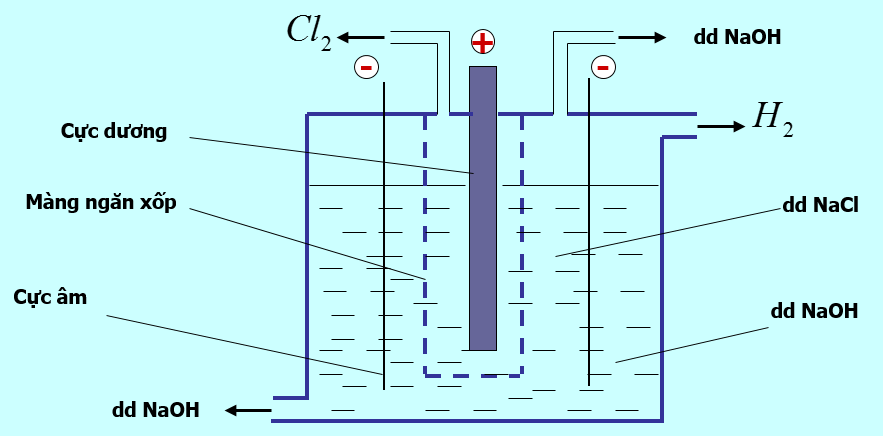
1.1.4. Sản xuất natri hidroxit
- NaOH được điều chế bằng cách điện phân dung dịch NaCl
Hình 3: Điện phân dung dịch NaCl
-
Tác dụng của màng ngăn xốp: Không cho khí Hiđro và clo tác dụng với nhau (không có màng ngăn xốp không thu được NaOH) H2 + Cl2 → 2HCl
-
Phương trình phản ứng: 2NaCl + 2H2O (Điện phân dung dịch, có màng ngăn) → 2NaOH + H2 + Cl2
1.2. Canxi Hidroxit - Thang pH
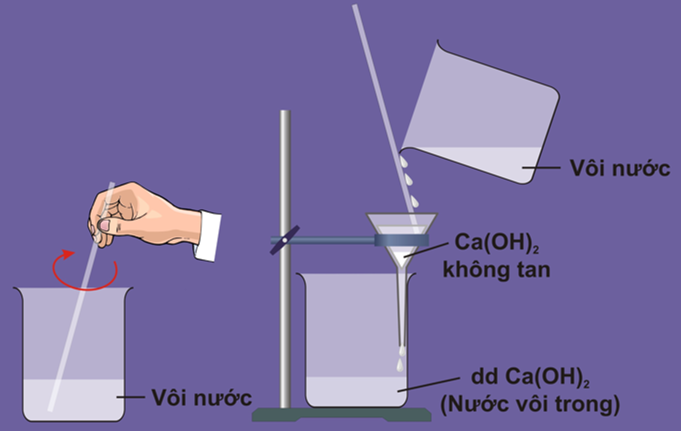
1.2.1. Pha chế dung dịch Canxit hidroxit
- Bước 1: ta lấy canxi hiđroxit cho vào nước khuấy đều.
- Bước 2: dùng giấy lọc, để lọc lấy chất lỏng trong suốt, không màu là dung dịch canxi hiđroxit (nước vôi trong).
Hình 4: Cách pha chế dung dịch Caxi hidroxit
1.2.2. Tính chất hóa học
a. Làm đổi màu chất chỉ thị
- dd Ca(OH)2 đổi màu quỳ tím thành xanh, hoặc đổi màu dd phenolptalein không màu thành màu hồng
b. Tác dụng với Axit (tạo muối và nước)
Phương trình hóa học:
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
HCl + Ca(OH)2 → CaCl2 + 2H2O
c. Tác dụng với oxit axit (tạo muối + nước)
Tuỳ theo tỉ lệ số mol của Ca(OH)2 với số SO2 mà có thể tạo muối trung hoà và nước, muối axit Hoặc cả hai muối.
Phương trình hóa học:
Ca(OH)2 + SO2 → CaSO3 + H2O
Ca(OH)2 + 2SO2 → Ca(HSO3)2
d. Tác dụng với dung dịch muối (Học ở bài 9)
1.2.3. Ứng dụng của Canxi hidroxit
- Làm vật liệu xây dựng
- Khử chua đất trồng trọt
- Khử độc các chất thải trong công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật
1.2.4. Thang pH
- Thang pH dùng để biểu thị độ axit hoặc độ bazơ của dung dịch
-
Nếu pH = 7 thì dung dịch là trung tính
-
Nếu pH > 7 thì dung dịch có tính bazơ ⇒ Nếu pH càng lớn, độ bazơ của dung dịch càng lớn và ngược lại
-
Nếu pH
-
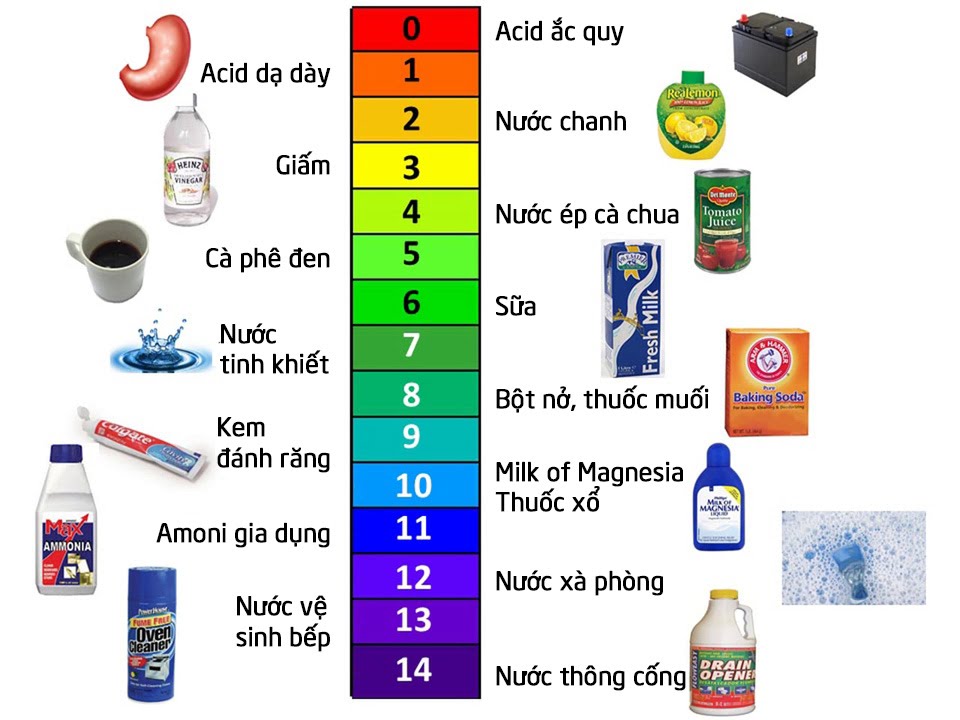
Hình 5: Thang pH
Bài 1:
Na2O → NaOH → Na2SO4 → BaSO4
Hướng dẫn:
Na2O + H2O → 2NaOH
2NaOH + H2SO4 → Na2SO4 + 2H2O
Hoặc : 2NaOH + SO3 → Na2SO4 + 2H2O
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Hoặc : Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3
Hoặc : Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
Bài 2:
Hòa tan 112 g KOH vào nước thì được 2 lit dung dịch. Nồng độ mol của dung dịch thu được là:
Hướng dẫn:
Số mol KOH là: \({n_{KOH}} = \frac{m}{M} = \frac{{112}}{{56}} = 2(mol)\)
Nồng độ mol của dung dịch thu được là:
\({C_M} = \frac{n}{V} = \frac{2}{2} = 1M\)
Bài 3:
Dẫn V lit CO2 (đktc) vào dung dịch chứa 3,7 gam Ca(OH)2. Sau phản ứng thu được 4 gam kết tủa. Tính V?
Hướng dẫn:
Theo bài ra ta có:
Số mol của Ca(OH)2 = \(\frac{{3,7}}{{74}}\) = 0,05 mol
Số mol của CaCO3 = \(\frac{4}{{100}}\) = 0,04 mol
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3 + H2O
Nếu CO2 không dư:
Ta có số mol CO2 = số mol CaCO3 = 0,04 mol
Vậy V(đktc) = 0,04 x 22,4 = 0,896 lít
Nếu CO2 dư:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,05 \(\leftarrow\) 0,05 mol → 0,05
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,01 \(\leftarrow\) (0,05 - 0,04) mol
Vậy tổng số mol CO2 đã tham gia phản ứng là: 0,05 + 0,01 = 0,06 mol
V(đktc) = 22,4 x 0,06 = 1,344 lít
3. Luyện tập Bài 8 Hóa học 9
Sau bài học cần nắm:
- Natri hidroxit NaOH và Canxi hidroxit Ca(OH)2 có những tính chất vật lí, tính chất hóa học nào?
- Những ứng dụng trong đời sống và sản xuất gồm những gì?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 8 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Na2CO3
- B. KCl
- C. NaOH
- D. NaNO3
-
- A. HCl, NaOH
- B. H2SO4, HNO3
- C. NaOH, Ca(OH)2
- D. BaCl2, NaNO3
-
- A. Quỳ tím
- B. HCl
- C. NaCl
- D. H2SO4
-
- A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
- B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
- C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt
- D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
-
- A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
- B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
- C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
- D. Zn(OH)2, Ca(OH)2, KOH, NaOH
-
- A. CO2, Na2O.
- B. CO2, SO2.
- C. SO2, K2O
- D. SO2, BaO
Câu 2- Câu 10: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 8.
Bài tập 3 trang 27 SGK Hóa học 9
Bài tập 1 trang 30 SGK Hóa học 9
Bài tập 2 trang 30 SGK Hóa học 9
Bài tập 3 trang 30 SGK Hóa học 9
Bài tập 4 trang 30 SGK Hóa học 9
Bài tập 8.1 trang 9 SBT Hóa học 9
Bài tập 8.2 trang 9 SBT Hóa học 9
Bài tập 8.3 trang 10 SBT Hóa học 9
Bài tập 8.4 trang 10 SBT Hóa học 9
Bài tập 8.5 trang 10 SBT Hóa học 9
Bài tập 8.6 trang 10 SBT Hóa học 9
Bài tập 8.7 trang 10 SBT Hóa học 9
4. Hỏi đáp về Bài 8 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK