Hoá học 9 Bài 2: Một số oxit quan trọng
Tóm tắt bài
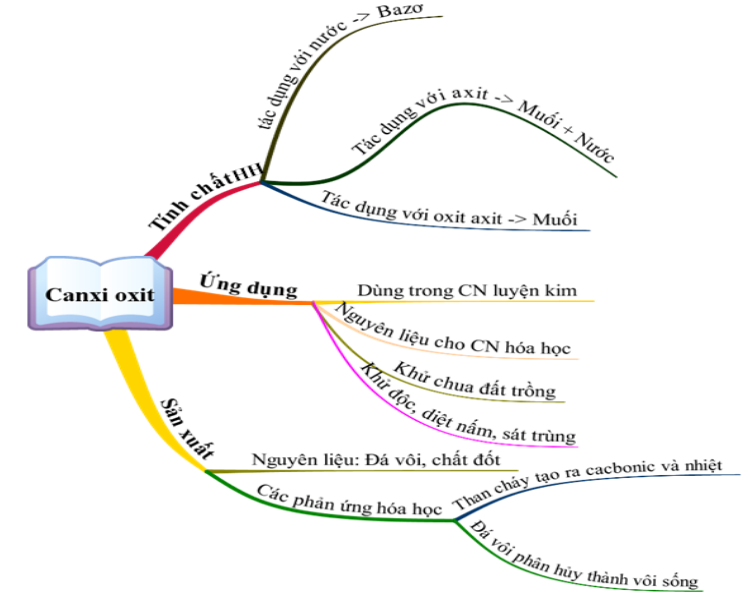
1.1. Canxi oxit (CaO)
1.1.1. Canxi oxit có những tính chất nào?
- Là chất rắn màu trắng, nóng chảy ở nhiệt độ rất cao (25850C).
- Canxi oxit có đầy đủ tính chất của một oxit bazơ
a. Tác dụng với nước
- Ca(OH)2 tan ít trong nước, phần tan tạo thành dung dịch bazơ.
- Thí nghiệm: Canxi oxit tác dụng với nước
Video 1: Canxi oxit tác dụng với nước
-
Phản ứng trên là phản ứng tôi vôi, phản ứng tỏa nhiệt mạnh CaO + H2O → Ca(OH)2
-
CaO có tính hút ẩm nên dùng để làm khô nhiều chất.
b. Tác dụng với axit
- Thí nghiệm Canxi oxit tác dụng với axit hidroclorua:
Video 2: Phản ứng giữa CaO và HCl
- Phương trình phản ứng; CaO + H2SO4 → CaSO4 + H2O (phản ứng tỏa nhiệt)
- Nhờ tính chất này mà CaO được dùng để khử chua đất trồng trọt, xử lý nước thải của các nhà máy,...
c. Tác dụng với oxit axit
- Vôi sống để lâu trong không khí không có lợi vì xảy ra phản ứng: CaO + CO2
CaCO3
- Để hạn chế phản ứng này người ta thường tôi vôi ngay sau khi nung.
1.1.2. Canxi oxit có những ứng dụng gì?
Dùng trong công nghiệp luyện kim, nguyên liệu cho công nghiệp hóa học, khử chua đất trồng, xử lí nước thải, sát trùng,...
1.1.3. Sản xuất Canxi oxit
a. Nguyên liệu: đá vôi.
Chất đốt là than đá, củi, dầu, khí tự nhiên,...
b. Các phản ứng hóa học xảy ra:
Than cháy tạo ra CO2, phản ứng tỏa nhiều nhiệt: C + O2 → CO2.
Nhiệt sinh ra phân hủy đá vôi thành vôi sống: CaCO3 .PNG)
Hình 1: Tính chất hóa học của canxi oxit
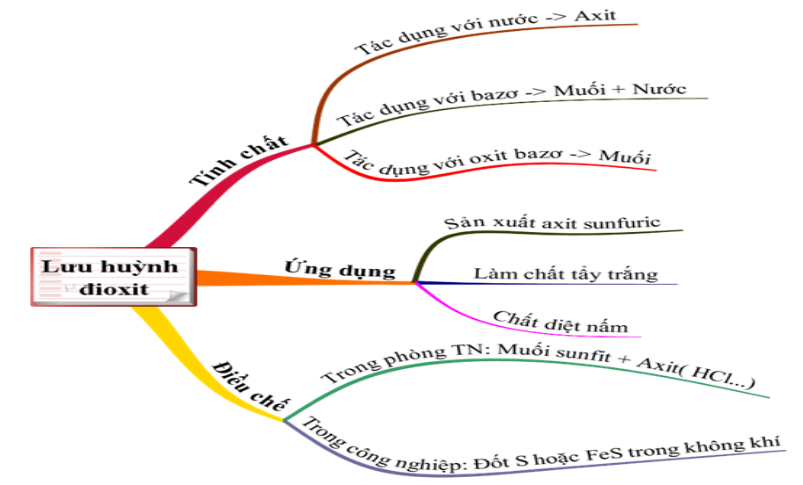
1.2. Lưu huỳnh đioxit (SO2)
1.2.1. Lưu huỳnh đioxit có những tính chất nào?
-
Lưu huỳnh đioxit là chất khí không màu, mùi hắc, độc, nặng hơn không khí.
-
SO2 mang đầy đủ tính chất của một oxit axit
a. Tác dụng với nước
- Dẫn khí SO2 vào cốc đựng nước, sau đó thử dung dịch thu được bằng quỳ tím, thấy quỳ tím chuyển sang màu đỏ. (Trong phòng thí nghiệm người ta điều chế bằng cách nung nóng chảy lưu huỳnh cho tác dụng với oxi thu được khí SO2)
- Thí nghiệm được tiến hành như sau:
Video 3: Phản ứng giữa lưu huỳnh đioxit với nước
- Phương trình hóa học: SO2 + H2O → H2SO3
- SO2 là chất gây ô nhiễm không khí, là một trong các nguyên nhân gây ra mưa axit.
b. Tác dụng với bazơ
- Dẫn khí SO2 vào cốc đựng dung dịch Ca(OH)2 thấy xuất hiện kết tủa trắng (CaSO3)
- Phương trình hóa học: SO2+ Ca(OH)2 → CaSO3 + H2O
c. Tác dụng với oxit bazơ
-
SO2 tác dụng với oxit bazơ (CaO, Na2O,...) tạo muối sunfit.
-
Phương trình hóa học: SO2 + Na2O → Na2SO3
Hình 2: Tính chất hóa học của CO2
1.2.2. Lưu huỳnh đioxit có những ứng dụng gì?
Phần lớn SO2 dùng để sản xuất H2SO4, dùng làm chất tẩy trắng bột gỗ, diệt nấm mốc,...
1.2.3. Điều chế lưu huỳnh đioxit
a. Điều chế trong phòng thí nghiệm
-
Cho muối sunfit tác dụng với dung dịch axit (HCl, H2SO4)
-
Phương trình hóa học: Na2SO3+H2SO4→ Na2SO4 + H2O + SO2
b. Điều chế trong công nghiệp
- Đốt S trong không khí: S + O2
SO2
- Đốt quặng pirit sắt (FeS2) thu được SO2 : 4FeS2 + 11O2
2Fe2O3 + 8SO2
Bài 1:
Nêu phương pháp hóa học nhận biết từng nhóm chất sau:
a) Hai chất rắn màu trắng là: CaO và P2O5
b) Hai chất khí không màu là SO2 và O2
Hướng dẫn:
a) Cho mỗi chất tác dụng với nước, sau đó thử dung dịch thu được bằng quỳ tím, dung dịch nào làm quỳ chuyển sang màu xanh là dung dịch Ca(OH)2
⇒ Chất rắn là CaO, dung dịch làm quỳ chuyên sang màu đỏ là dung dịch H3PO4 => chất rắn là P2O5.
Phương trình hóa học:
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
b) Dẫn lần lượt hai khí qua dung dịch nước vôi trong, khí nào làm đục nước vôi trong
⇒ khí đó là SO2, khí O2 không làm đục nước vôi trong.
Phương trình hóa học:
SO2 +Ca(OH)2→CaSO4+H2O
Bài 2:
Cho 5,6g CaO vào nước tạo thành dung dịch A. Tính số gam kết tủa tạo thành khi đem dung dịch A hấp thụ hoàn toàn 2,8 lít khí cacbonic.
Hướng dẫn:
Số mol của CaO và CO2 bằng:
\(\begin{array}{*{20}{l}} {{n_{CaO}} = \frac{{\;5,6}}{{56}} = {\rm{ }}0,1{\rm{ }}mol}\\ {{n_{CO2}} = \;\frac{{2,8}}{{22,4}}\; = {\rm{ }}0,125{\rm{ }}mol} \end{array}\)
Ta có phương trình phản ứng
CaO + H2O → Ca(OH)2
0,1mol 0,1mol
Ca(OH)2 + CO2 → CaCO3 + H2O
0,1mol 0,1mol 0,1mol
- Số mol CO2 dư: 0,125 – 0,1 = 0,025 mol, sẽ tiếp tục phản ứng như sau:
CaCO3 + H2O + CO2 → Ca(HCO3)2.
0,025mol 0,025mol 0,025mol
- Số gam CaCO3 kết tủa là: (0,1 – 0,025).100 = 7,5g.
3. Luyện tập Bài 2 Hóa học 9
Sau bài học cần nắm:
- Tính chất vật lý và hóa học của canxi oxit
- Các ứng dụng và cách điều chế Canxi oxit - lưu huỳnh đioxit.
- Khái quát về sự phân loại oxit đi sâu tìm hiểu tính chất hóa học và giúp học sinh nắm bắt được cơ sở phân loại oxit.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 2 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. CaO tác dụng với O2
- B. CaO tác dụng với CO2
- C. CaO dụng với nước
- D. Cả B và C
-
- A. Tác dụng với axit
- B. Tác dụng với bazơ
- C. Tác dụng với oxit axit
- D. Tác dụng với muối
-
- A. Dung dịch phenolphtalein
- B. Giấy quỳ ẩm
- C. Dung dịch axit clohiđric
- D. A , B và C đèu đúng
-
- A. CuO
- B. ZnO
- C. PbO
- D. CaO
-
- A. CO
- B. CO2
- C. SO2
- D. CO2 và SO2
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 2.
Bài tập 2.5 trang 4 SBT Hóa học 9
Bài tập 2.6 trang 4 SBT Hóa học 9
Bài tập 2.7 trang 4 SBT Hóa học 9
Bài tập 2.8 trang 5 SBT Hóa học 9
Bài tập 2.9 trang 5 SBT Hóa học 9
Bài tập 2.10 trang 5 SBT Hóa học 9
4. Hỏi đáp về Bài 2 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK