Hoá học 9 Bài 10: Một số muối quan trọng
Tóm tắt bài
1.1. Muối Natriclorua (NaCl = 58,5)
1.1.1. Trạng thái thiên nhiên
- Trong nước biển thành phần chủ yếu là NaCl. (1m3 nước biển chứa 27kg NaCl, 5kg MgCl2, 1kg CaSO4 và một số muối khác).
- Muối NaCl còn có trong các mỏ muối.
1.1.2. Cách khai thác
- Cho nước biển (mặn) bay hơi từ từ → Muối kết tinh.
- Đào hầm, đào giếng sâu qua các lớp đất đá → Đem muối mỏ nghiền nhỏ → Tinh chế để có muối sạch.

Hình 1: Ruộng muối
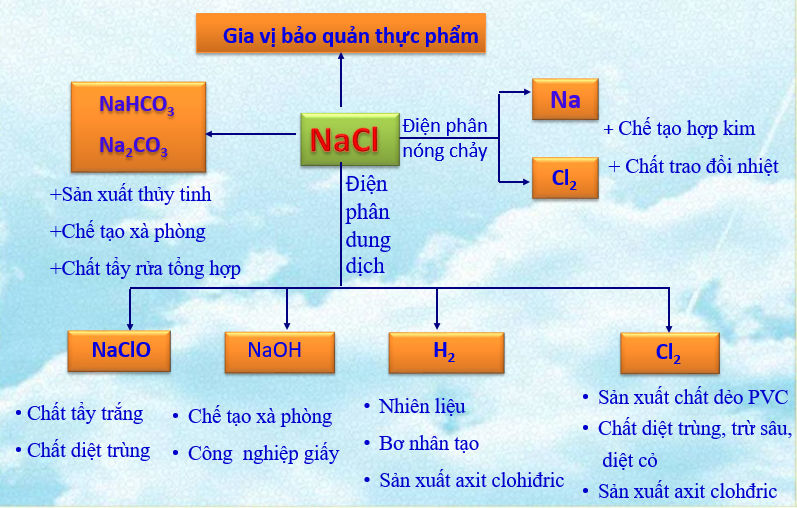
1.1.3. Ứng dụng
Hình 2: Ứng dụng của muối NaCl
1.2. Muối Kali nitrat (KNO3 = 101)
Kali nitrat còn có tên gọi khác là Diêm tiêu, là chẩt rắn màu trắng
1.2.1. Tính chất
Muối KNO3 tan nhiều trong nước, bị phân hủy ở nhiệt độ cao. Muối KNO3 có tính chất ôxi hóa mạnh.
2KNO3 → 2KNO2 + O2
1.2.2. Ứng dụng
- Chế tạo thuốc nổ đen .
- Làm phân bón (cung cấp nguyên tố nitơ và kali cho cây trồng)
- Bảo quản thực phẩm trong công nghiệp.
Bài 1:
Viết các phương trình phản ứng hóa học theo sơ đồ sau:
Na2O → NaOH → Na2SO3 → SO2 → K2SO3
Hướng dẫn:
Na2O + H2O → 2NaOH
SO2 + 2 NaOH → Na2SO3+ H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
SO2 + K2O → K2SO3
Bài 2:
Hoà tan trong nước 0,325g một hỗn hợp gồm 2 muối Natriclorua và Kaliclorua. Thêm vào dung dịch này một dung dịch bạc Nitrat lấy dư - Kết tủa bạc clorua thu được có khối lượng là 0,717g. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
Hướng dẫn:
Gọi MNaCl là x và mKCl là y ta có phương trình đại số:
x + y = 0,35 (1)
Phương trình hóa học:
NaCl + AgNO3 → AgCl + NaNO3
KCl + AgNO3 → AgCl + KNO3
Dựa vào 2 phương trình hóa học ta tìm được khối lượng của AgCl trong mỗi phản ứng:
m’AgCl = x .\(\frac{{{M_{AgCl}}}}{{{M_{NaCl}}}}\)= x . \(\frac{{143}}{{58,5}}\)= x . 2,444
mAgCl = y .\(\frac{{{M_{AgCl}}}}{{{M_{kcl}}}}\)= y . \(\frac{{143}}{{74,5}}\)= y . 1,919
=> mAgCl = 2,444x + 1,919y = 0,717 (2)
Từ (1) và (2) => hệ phương trình \(\left\{ \begin{array}{l} x + y = 0,325\\ 2,444x + 1,919y = 0,717 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,178\\ y = 0,147 \end{array} \right.\)
=> % NaCl = \(\frac{{0,178}}{{0,325}}\).100% = 54,76%
% KCl = 100% - % NaCl = 100% - 54,76% = 45,24%.
Vậy trong hỗn hợp: NaCl chiếm 54,76%, KCl chiếm 45,24%
3. Luyện tập Bài 10 Hóa học 9
Sau bài học cần nắm: hợp chất muối quan trọng là Natriclorua và Kali nitrat có những tính chất gì và ứng dụng ra sao?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 10 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Nước biển.
- B. Nước mưa.
- C. Nước sông.
- D. Nước giếng.
-
- A. NO.
- B. N2O.
- C. N2O5
- D. O2.
-
- A. H2 và O2
- B. H2 và Cl2
- C. O2 và Cl2
- D. Cl2 và HCl
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 10.
Bài tập 1 trang 36 SGK Hóa học 9
Bài tập 2 trang 36 SGK Hóa học 9
Bài tập 3 trang 36 SGK Hóa học 9
Bài tập 4 trang 36 SGK Hóa học 9
Bài tập 5 trang 36 SGK Hóa học 9
Bài tập 10.3 trang 13 SBT Hóa học 9
Bài tập 10.1 trang 13 SBT Hóa học 9
Bài tập 10.2 trang 13 SBT Hóa học 9
Bài tập 10.4 trang 13 SBT Hóa học 9
Bài tập 10.5 trang 13 SBT Hóa học 9
4. Hỏi đáp về Bài 10 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK