Hoá học 9 Bài 4: Một số axit quan trọng
Tóm tắt bài
1.1. Axit clohidric
1.1.1. Tính chất hóa học (HCl có đầy đủ tính chất hóa học của axit)
-
Làm quỳ tím chuyển sang màu đỏ
-
Tác dụng với kim loại: 2Al ( r) + 6HCl (dd) → 2 AlCl3 (dd) + 3H2 (k)
-
Tác dụng với Bazơ: Cu(OH)2(r)+2HCl(dd) → CuCl2(dd)+ 2H2O(l)
-
Tác dụng với oxit bazơ: CuO (r) + 2HCl (dd) → CuCl2(dd) + H2O
-
Tác dụng với muối: (Học trong bài 9)
1.1.2. Ứng dụng
-
Điều chế các muối
-
Làm sạch bề mặt kim loại trước khi hàn
-
Tẩy gỉ kim loại trước khi tráng, sơn, mạ kim loại
-
Chế biến thực phẩm, dược phẩm
1.2. Axit sunfuric (H2SO4)
1.2.1. Tính chất vật lí
- Chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, toả rất nhiều nhiệt
- Lưu ý: Khi pha H2SO4 loãng , ta cho từ từ axit vào lọ nước ( Không làm ngược lại vì nguy hiểm)
1.2.2. Tính chất hóa học
-
Axit H2SO4 loãng (H2SO4l)
Làm quỳ tím hoá đỏ
Tác dụng với kim loại → muối + nước.
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 1: Phản ứng của Mg và dung dịch H2SO4
- Hiện tượng: Xuất hiện khí không màu
- Giải thích: Khí không màu là khí H2 sinh ra do có phản ứng Mg + H2SO4l → MgSO4 + H2.
Tác dụng với bazơ → muối + nước
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 2: Phản ứng giữa dung dịch Cu(OH)2 và H2SO4
- Hiện tượng: Cu(OH)2 tan dần và tạo dung dịch màu xanh
- Giải thích: Do xảy ra phản ứng H2SO4l+Cu(OH)2 → CuSO4 + 2H2O
Tác dụng với oxit bazơ → muối + nước
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 3: Phản ứng giữa Fe2O3 và H2SO4
- Hiện tượng: Bột Fe2O3 tan dần, tạo dung dịch màu nâu
- Giải thích: Do xảy ra phản ứng 3H2SO4l +Fe2O3 → Fe2(SO4)3+3H2O
Tác dụng với muối
1.2.3 Axit sunfuric đặc có những tính chất hóa học riêng
Tác dụng với kim loại
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 4: Thí nghiệm Đồng với axit sunfuric loãng và đặc
- Hiện tượng:
- ống nghiệm 1: Không có hiện tượng gì (Các em thấy giống như có bọt khí thoát ra nhưng đó là do nước sôi, hơi nước bay ra thôi, dây Đồng vẫn còn giữ nguyên màu sắc)
- ống nghiệm 2: Có khí không màu, mùi hắc thoát ra nhiều; Đồng bị tan một phần tạo dung dịch màu xanh lam.
- Giải thích:
- H2SO4 đặc, nóng tác dụng được với Đồng, tạo khí SO2 không màu, mùi hắc; dung dịch CuSO4 màu xanh lam.
- Phương trình phản ứng: Cu + 2H2SO4 (đ)
CuSO4 + SO2 + 2H2O
-
Nhận xét: H2SO4 đặc tác dụng với nhiều kim loại khác → muối sunfat, không giải phóng khí H2
Tính háo nước
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 5: Thí nghiệm chứng minh tính háo nước của axit sunfuric đặc
- Hiện tượng: Màu trắng của đường chuyển sang nâu rồi thành màu đen xếp rồi bị bọt khí đẩy trào ra khỏi miệng cốc, tỏa nhiệt nhiều.
- Giải thích: Chất rắn màu đen là Cacbon. Người ta nói axit sunfuric đặc có tính háo nước với phương trình C12H22O11
11H2O + 12C
1.2.3. Ứng dụng
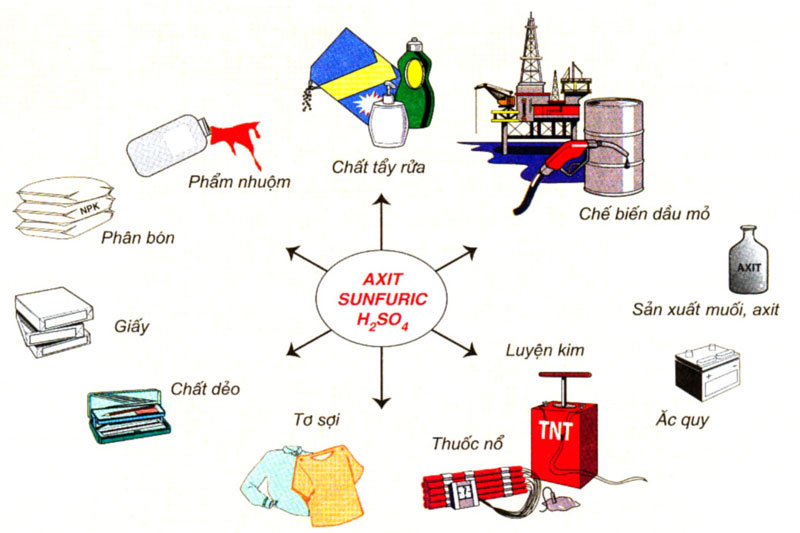
Hình 1: Ứng dụng của axit sunfuric
1.2.4. Sản xuất axit sunfuric
Trong Công nghiệp Axit sunfuric được sản xuất bằng phương pháp tiếp xúc.
a. Nguyên liệu: Lưu huỳnh hoặc Quặng Pyritsắt (FeS2)
b. Các công đoạn chính:
- Sản xuất lưu huỳnh đioxit:
- S + O2
SO2
- Hoặc 4FeS2 + 11O2
2Fe2O3 + 8SO2
- S + O2
- Sản xuất lưu huỳnh trioxit:
- 2SO2 + O2
2SO3
- 2SO2 + O2
- Sản xuất H2SO4:
- SO3 + H2O → H2SO4
Video 6: Quy trình sản xuất Axit sunfuric
1.2.5. Nhận biết axit Sunfuric và muối sunfat
- dd BaCl2; Ba(NO3)2 ; Ba(OH)2 được dùng làm thuốc thử để nhận ra gốc sunfat
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 7: Thí nghiệm giữa dung dịch BaCl2 và H2SO4
- Hiện tượng: Có kết tủa trắng xuất hiện
- Giải thích:
- Gốc =SO4 trong phân tử H2SO4 kết hợp với nguyên tố Bari trong phân tử BaCl2 tạo thành kết tủa BaSO4
- Phương trình hóa học: H2SO4 + BaCl2 → BaSO4 + 2HCl
1.3. Tổng kết
Hình 2: Tính chất hóa học của Axit sunfuric
Bài 1:
Cần phải điều chế một lượng Đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric?
a, Axit sunfuric tác dụng với Đồng (II) oxit
b. Axit sunfuric đặc tác dụng với Đồng kim loại.
Viết các phương trình hóa học và giải thích
Hướng dẫn:
Phương trình hóa học a: CuO + H2SO4 → CuSO4 + H2O
Phương trình hóa học b: Cu + 2H2SO4 (đ) .PNG)
Ở phản ứng a tỉ lệ phản ứng của Cu : H2SO4 là 1: 1 nên sẽ tiết kiệm được axit hơn phản ứng b theo tỉ lệ 1:2.
Hơn nữa ở phản ứng 2 tạo thêm sản phẩm SO2 là khí độc, mùi hắc là nguyên nhân chính tạo ra mưa axit gây ô nhiễm môi trường.
Bài 2:
Có 4 lọ không nhãn đựng 4 dung dịch không màu là: HCl, H2SO4, NaCl, Na2SO4. Hãy nhận biết dung dịch trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học.
Hướng dẫn:
Trích dẫn một ít dung dịch của 4 chất để làm mẫu thử rồi lần lượt tiến hành lần lượt như sau:
| Thuốc thử | HCl | H2SO4 | NaCl | Na2SO4 |
| Qùy tím | Đỏ | Đỏ | - | - |
| dung dịch BaCl2 | - | kết tủa trắng | - | Kết tủa trắng |
- Dung dịch nào làm quỳ tím hóa đỏ, và không hiện tượng với dung dịch BaCl2 là dung dịch HCl
- Dung dịch nào làm quỳ tím hóa đỏ, và có kết tủa trắng với dung dịch BaCl2 là dung dịch H2SO4
- Dung dịch nào không làm đổi màu quỳ tím, và không hiện tượng với dung dịch BaCl2 là dung dịch NaCl
- Dung dịch nào không làm đổi màu quỳ tím, và có kết tủa trắng với dung dịch BaCl2 là dung dịch Na2SO4
Bài 3:
Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
a. Tính khối lượng dung dịch NaOH cần dùng.
b. Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?
Hướng dẫn:
a. Phương trình hóa học: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Số mol H2SO4 là: nH2SO4 = 0,3 . 1,5 = 0,45 mol
Khối lượng NaOH cần dùng: mNaOH = 2. 0,45. 40 = 36g.
Khối lượng dung dịch NaOH 40%: mdd = 36.10040 = 90g
b. Phương trình phản ứng: H2SO4 + 2KOH → K2SO4 + 2 H2O
Khối lượng KOH cần dùng: mKOH = 2 . 0,45 . 56 = 50,4g
Khối lượng dung dịch KOH: mdd = 50,4.1005,6 = 900g
Thể tích dung dịch KOH cần dùng: vdd = mddD = 9001,045 = 861,2 ml
3. Luyện tập Bài 4 Hóa học 9
Sau bài học cần nắm:
- Biết được cách viết phương trình phản ứng thể hiện tính chất chung của axit.
- H2SO4 đặc có những tính chất hoá học riêng: Tính oxi hoá (tác dụng với những kim loại kém hoạt động) tính háo nước, dẫn ra được những phản ứng minh họa cho những tính chất này.
- Những ứng dụng quan trọng của axit trong sản xuất, trong đời sống.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 4 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Rót từng giọt nước vào axit
- B. Rót từng giọt axit vào nước
- C. Cho cả nước và axit vào cùng một lúc
- D. Cả 3 cách trên đều được
-
- A. Sắt (II) clorua và khí hiđrô
- B. Sắt (III) clorua và khí hiđrô.
- C. Sắt (II) Sunfua và khí hiđrô
- D. Sắt (II) clorua và nước
-
- A. Vàng đậm
- B. Đỏ
- C. Xanh lam
- D. Da cam
-
- A. SO2.
- B. CO2
- C. CuO
- D. CO.
-
- A. CO2
- B. SO2.
- C. SO3
- D. H2S
-
- A. Sủi bọt khí, đường không tan.
- B. Màu trắng của đường mất dần, không sủi bọt.
- C. Màu đen xuất hiện và có bọt khí sinh ra.
- D. Màu đen xuất hiện, không có bọt khí sinh ra.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 4.
Bài tập 4 trang 19 SGK Hóa học 9
Bài tập 5 trang 19 SGK Hóa học 9
Bài tập 6 trang 19 SGK Hóa học 9
Bài tập 7 trang 19 SGK Hóa học 9
Bài tập 4.1 trang 6 SBT Hóa học 9
Bài tập 4.2 trang 6 SBT Hóa học 9
Bài tập 4.3 trang 7 SBT Hóa học 9
Bài tập 4.4 trang 7 SBT Hóa học 9
Bài tập 4.5 trang 7 SBT Hóa học 9
Bài tập 4.6 trang 7 SBT Hóa học 9
Bài tập 4.7 trang 7 SBT Hóa học 9
Bài tập 4.8 trang 7 SBT Hóa học 9
4. Hỏi đáp về Bài 4 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)