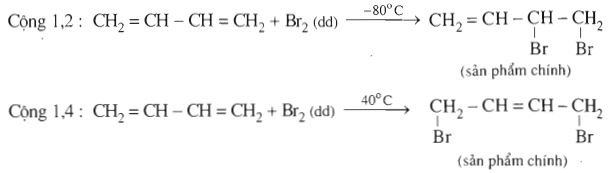Hoá học 11 Bài 30 Ankađien
Tóm tắt bài
1.1. Định nghĩa và phân loại
1.1.1. Định nghĩa
- Ankađien là hidrocacbon không no, mạch hở. Trong phân tử có chứa 2 liên kết đôi.
- Công thức tổng quát: CnH2n-2 (n≥3).
- Ví dụ:
CTPT CTCT
C3H4 CH2= C = CH2 propađien (allen)
C4H6 CH2 = C= CH – CH3
CH2 = CH – CH= CH2 buta- 1,3- đien
- Cách gọi tên: Số chỉ vị trí nhánh- tên nhánh + tên mạch chính+ a – Số chỉ vị trí nối đôi- đien.
1.1.2. Phân loại
- Dựa vào vị trí liên kết đôi, có thể chia ankađien thành 3 loại
- Ankađien có 2 liên kết đôi cạnh nhau: CH2=C=CH2
- Ankađien có liên kết đôi cách nhau bởi 1 liên kết đơn gọi là ankađien liên hợp.CH2 = CH – CH= CH2. Ankađien liên hợp có nhiều tính chất, ứng dụng quan trọng, đặc biệt là buta- 1,3- đien và isopren.
- Ankađien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên: CH2=CH-CH2-CH=CH2
- Ankađien liên hợp có nhiều tính chất, ứng dụng quan trọng, đặc biệt là buta- 1,3- đien và isopren.
1.2. Tính chất hóa học
1.2.1. Phản ứng cộng
a. Cộng Hidro
CH2=CH-CH= CH2 + 2H2 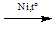
b. Cộng Brom
Cộng đồng thời vào liên kết đôi
CH2=CH-CH=CH2 + 2Br2 → CH2Br-CHBr-CHBr-CH2Br
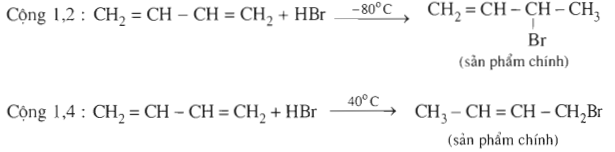
c. Cộng Hiđro halogenua
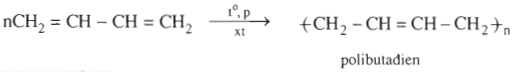
1.2.2. Phản ứng trùng hợp
Khi có mặt kim loại Natri hoặc chất xúc tác khác, buta- 1,3- đien tham gia phản ứng, chủ yếu trùng hợp theo kiểu 1,4.
1.2.3. Phản ứng oxi hóa
a. Phản ứng oxi hóa hoàn toàn
\(2{C_n}{H_{2n - 2}} + (3n - 1){O_2} \to 2nC{O_2} + 2(n - 1){H_2}{\rm{O}}\)
2C4H6 + 11O2 .PNG)
b. Phản ứng oxi hóa không hoàn toàn
Buta-1,3-dien và isopren cũng làm mất màu dung dịch kali pemanganat tương tự anken
1.3. Điều chế
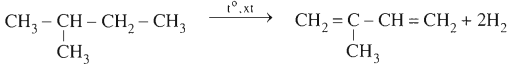
1.3.1. Điều chế buta-1,3-dien
CH3-CH2-CH2-CH3 .PNG)
1.3.2. Điều chế isopren
1.4. Ứng dụng
- Điều chế polibutadien hoặc polisopren là những chất có tính đàn hồi cao.
- Dùng để sản xuất cao su (cao su buna, cao su isopren ...)
Bài 1:
Oxi hóa hoàn toàn m gam hỗn hợp X gồm etilen; propilen; buta -1,3- dien cần vừa đủ 150ml dung dịch KMnO4 1M thu được hỗn hợp poliancol. Nếu lấy 2m gam hỗn hợp X tác dụng với nước brôm dư thì thu được 86,52 gam sản phẩm cộng. Giá trị của m là:
Hướng dẫn:
Dạng chung: R1 – CH = CH – R2 → R1 – CH(OH) – CH(OH) – R2
2C+a → 2C+a + 1 + 2e
Mn+7 + 3e → Mn+4
⇒ \(3n_{KMnO_{4}}\) = 2nC=C ⇒ nC=C = 0,225 mol
Xét 2m gam X thì có nC=C = 0,45 mol phản ứng với 0,45 mol Br2
Bảo toàn khối lượng: 2mX = msản phẩm – \(m_{Br_{2}}\)
⇒ m = 7,26g
3. Luyện tập Bài 30 Hóa học 11
Sau bài học cần nắm:
- Khái niệm, định nghĩa, công thức chung, phân loại, đặc điểm cấu tạo, đồng đẳng, đồng phân, danh pháp của ankađien.
- Phương pháp điều chế và ứng dụng của buta-1,3-đien và isopren.
- Tính chất hoá học của buta-1,3-đien và isopren: phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 30 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 3-metylbuta-1,3-dien
- B. 2-Vinylpropen
- C. 2-Metybuta-1,3-dien
- D. Isobuta-1,3-dien
-
- A. 3-Brom-But-1-en
- B. 4-Brom-But-1-en
- C. 1,4-đibrombutan
- D. 1,2-đibrombutan
-
- A. X thuộc lọai không no
- B. X là Ankađien
- C. X có độ bất bão hòa k > 1
- D. X có ít nhất 2 liên kết đôi
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 30.
Bài tập 30.2 trang 46 SBT Hóa học 11
Bài tập 30.3 trang 47 SBT Hóa học 11
Bài tập 30.4 trang 47 SBT Hóa học 11
Bài tập 30.5 trang 47 SBT Hóa học 11
Bài tập 30.6 trang 47 SBT Hóa học 11
Bài tập 30.7 trang 47 SBT Hóa học 11
Bài tập 1 trang 168 SGK Hóa học 11 nâng cao
Bài tập 2 trang 168 SGK Hóa học 11 nâng cao
Bài tập 3 trang 169 SGK Hóa học 11 nâng cao
Bài tập 4 trang 169 SGK Hóa học 11 nâng cao
Bài tập 5 trang 169 SGK Hóa học 11 nâng cao
Bài tập 6 trang 169 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 30 Chương 6 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

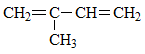
.PNG)