Đề thi HK1 môn Hóa 10 năm 2020 Trường THPT Trần Hưng Đạo
Câu hỏi 2 :
Hóa trị và số oxi hóa của N trong phân tử HNO3 lần lượt là gì?
A. 4 và -3
B. 3 và +5
C. 4 và +5
D. 5 và -3
Câu hỏi 3 :
Hòa tan 1 hỗn hợp 14,5 gam (Fe, Mg, Zn) bằng dung dịch HCl vừa đủ thì thu được dung dịch X có chứa 35,8 gam muối. Tính thể tích khí H2 thu được sau phản ứng.
A. 6,72 lít
B. 5,6 lít
C. 4,48 lít
D. 7,2 lít
Câu hỏi 4 :
Cho 5 gam Mg, Zn vào dung dịch HCl dư thu được 3,136 lít H2. Số mol Mg thu được là?
A. 0,2 mol
B. 0,1 mol
C. 0,3 mol
D. 0,4 mol
Câu hỏi 5 :
Cho 9,32 gam Mg và Zn vào 200 ml dung dịch H2SO4 2M. Hãy cho biết kết luận nào sau đây đúng?
A. Mg và Zn tan hết, H2SO4 dư
B. Mg và Zn, H2SO4 đều hết
C. Mg và Zn dư, H2SO4 hết
D. Mg hết, H2SO4 hết, Zn dư
Câu hỏi 6 :
Cho 13,5 gam nhôm tác dụng vừa đủ với 2,5 lít dung dịch HNO3, phản ứng tạo ra muối nhôm và một hỗn hợp khí gồm NO và N2O có tỉ lệ mol tương ứng là 2: 3. Tính nồng độ mol của dung dịch HNO3?
A. 0,95.
B. 0,86.
C. 0,76.
D. 0,9.
Câu hỏi 7 :
Hòa tan hoàn toàn 6,5 gam kim loại Zn vào dung dịch HNO3 loãng, giả sử chỉ thu được 0,448 lít khí X duy nhất (đktc). Khí X là gì?
A. N2.
B. NO.
C. N2O.
D. NO2.
Câu hỏi 8 :
Hòa tan 8,4 gam Fe trong dung dịch HNO3 dư, tính thể tích khí NO bay ra, biết NO là sản phẩm khử duy nhất của HNO3?
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,6 lít
Câu hỏi 9 :
Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hoàn toàn hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 0,56 lít (đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là?
A. 2,52.
B. 2,22.
C. 2,62.
D. 2,32.
Câu hỏi 10 :
Nung hỗn hợp X gồm 13,44 gam Fe và 7,02 gam Al trong không khí một thời gian, thu được 28,46 gam chất rắn Y. Cho Y tác dụng với dung dịch H2SO4 đặc, nóng dư, thu được V lít khí SO2 (đktc). Giá trị của V là bao nhiêu?
A. 11,2.
B. 22,4.
C. 5,6.
D. 13,44.
Câu hỏi 11 :
Phản ứng nhiệt phân muối thuộc phản ứng nào?
A. oxi hóa – khử.
B. không oxi hóa – khử.
C. oxi hóa – khử hoặc không.
D. thuận nghịch.
Câu hỏi 12 :
Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là bao nhiêu?
A. 8
B. 6
C. 5
D. 7
Câu hỏi 13 :
Cho các phản ứng sau :a. FeO + H2SO4 đặc nóng →
A. a, b, d, e, f, h.
B. a, b, d, e, f, g.
C. a, b, c, d, e, g.
D. a, b, c, d, e, h.
Câu hỏi 15 :
Hòa tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,03 mol N2O và 0,01 mol NO. Giá trị của m là?
A. 8,1 gam.
B. 13,5 gam.
C. 2,43 gam.
D. 1,35 gam.
Câu hỏi 16 :
Nguyên tố Y là phi kim thuộc chu kì 3 của bảng tuần hoàn, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO3. Nguyên tố Y tạo với kim loại M cho hợp chất có công thức MY2, trong đó M chiếm 46,67 % về khối lượng. M là chất nào?
A. Mg.
B. Fe.
C. Cu.
D. Zn.
Câu hỏi 17 :
Phản ứng oxi hóa – khử là một trong những quá trình quan trọng nhất của thiên nhiên. Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hang loạt quá trình sinh học khác đều có cơ sở là phản ứng oxi hóa- khử. Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các quá trình xảy ra trong pin, acquy đều bao gồm sự oxi hóa và sự khử. Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học... đều không thực hiện được nếu thiếu các phản ứng oxi hóa – khử. Đặc điểm của phản ứng oxi hóa – khử là gì?
A. có một nguyên tố thay đổi số oxi hóa.
B. xảy ra đồng thời hai quá trình nhường và nhận electron.
C. chất khử và chất oxi hóa là các chất riêng biết.
D. luôn có một chất đóng vai trò là môi trường.
Câu hỏi 18 :
Cho các nhận định sau đây:(1) Trong cùng chu kì, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử giảm, tính phi kim tăng.
A. 3
B. 4
C. 5
D. 6
Câu hỏi 19 :
Hòa tan hoàn toàn 18,4 gam hỗn hợp hai muối cacbonat của hai kim loại X, Y thuộc nhóm IIA và thuộc hai chu kì liên tiếp bằng dung dịch HCl thu được 4,48 lít CO2 (đktc). Hai kim loại X, Y là gì?
A. Be và Mg.
B. Ca và Sr.
C. Mg và Ca.
D. Sr và Ba.
Câu hỏi 20 :
Quá trình oxi hóa xảy ra trong phản ứng: \(Fe + CuS{O_4} \to FeS{O_4} + Cu\) là?
A. Fe → Fe2+ + 2e
B. Fe + 2e → Fe2+
C. Cu2+ + 2e → Cu
D. Cu2+ → Cu + 2e
Câu hỏi 21 :
Chọn phát biểu không đúng trong các câu sau đây?
A. Chất oxi hóa là chất nhận electron và số oxi hoá giảm sau phản ứng.
B. Cho các nguyên tố sau: 11X, 11Y, 13Z. Sắp xếp theo chiều tang dần tính kim loại là: Y < X < Z.
C. Tất cả các nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là 8e ( trừ He ).
D. Trong phản ứng: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O\) , tỉ lệ giữa số nguyên tử clo đóng vai trò chất oxi hóa và số nguyên tử clo dóng vai trò chất khử là 1:5.
Câu hỏi 22 :
Ion X3- có cấu hình electron lớp ngoài cùng là: 3s23p6. Thành phần phần trăm về khối lượng của X trong hidroxit cao nhất là bao nhiêu?
A. 32,65%.
B. 31,63%.
C. 60%.
D. 37,35%.
Câu hỏi 23 :
Nhận xét nào dưới đây không đúng về các nguyên tố nhóm VIIIA?
A. Lớp electron ngoài cùng đã bão hào, bền vững.
B. Hầu như trơ, không tham gia phản ứng hóa học ở điều kiện thường.
C. Nhóm VIIIA dọi là nhóm khí hiếm.
D. Nguyên tử của chúng luôn có 8 electron lớp ngoài cùng.
Câu hỏi 24 :
Nguyên tử của nguyên tố X có 11 proton, nguyên tố Y có số hiệu nguyên tử là 8. Nguyên tố X khi tạo thành liên kết hóa học với nguyên tố Y thì nguyên tử Y sẽ?
A. nhận 2 electron tạo thành ion có điện tích 2-.
B. nhường 1 electron tạo thành ion có điện tích 1+.
C. góp chung 1 electron tạo thành 1 cặp electron chung.
D. nhường 2 electron tạo thành ion có điện tích 2+.
Câu hỏi 25 :
Cho sơ đồ: \(Fe \to F{e^{3 + }} + 3e.\) Sơ đồ trên biểu diễn quá trình nào?
A. quá trình khử.
B. quá trình oxi hóa.
C. quá trình nhận e.
D. quá trình trao đổi.
Câu hỏi 26 :
Cation R+ có cấu tạo như hình vẽ. Vị trí của R trong bảng tuần hoàn là gì?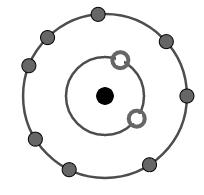
A. chu kì 3, nhóm VIIA.
B. chu kì 3, nhóm IA.
C. chu kì 4, nhóm IA.
D. chu kì 3, nhóm VIA.
Câu hỏi 27 :
Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành y tế - dược phẩm. Thành phần chính của nước đá khô là CO2, hãy chỉ ra nhận định sai trong các câu sau:
A. Liên kết giữa các nguyên tử oxi và cacbon thuộc loại liên kết cộng hóa trị phân cực.
B. Trong phân tử có hai liên kết đôi.
C. Phân tử CO2 không phân cực.
D. Phân tử có cấu tạo góc.
Câu hỏi 28 :
Cho các phát biểu sau:1.Số proton trong hạt nhân nguyên tử bằng số electron ở vỏ nguyên tử.
A. 1, 2.
B. 1, 3.
C. 2, 4.
D. 3, 4.
Câu hỏi 29 :
Nguyên tố hóa học A có số hiệu nguyên tử là 20, chu kì 4, nhóm IIA. Điều nhận xét nào sau đây là sai?
A. Số electron ở lớp vỏ của nguyên tử nguyên tố A là 20.
B. Lớp vỏ của nguyên tử nguyên tố A có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân nguyên tử của nguyên tố A có 20 proton.
D. Nguyên tố hóa học này là một phi kim.
Câu hỏi 30 :
Cho Mg (Z=12), Al (Z=13), K (Z=19), Ca (Z=20). Tính bazo của các hiđroxit nào sau đây lớn nhất?
A. KOH.
B. Ca(OH)2.
C. Mg(OH)2.
D. Al(OH)3.
Câu hỏi 31 :
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là gì?
A. N.
B. P.
C. Cl.
D. F.
Câu hỏi 32 :
Cho 8,3 gam Al và Fe tác dụng với HNO3 thu được 13,44 lít khí NO2 (đktc). Thành phần phần trăm về khối lượng của Al trong hỗn hợp là bao nhiêu?
A. 35,5%.
B. 32,53%.
C. 67,17%.
D. 56,15%.
Câu hỏi 33 :
Cho 2 gam một kim loại nhóm IIA tác dụng với dung dịch HCl tạo ra 5,55 gam muối clorua. Kim loại đó là gì?
A. Be.
B. Ba.
C. Ca.
D. Mg.
Câu hỏi 34 :
Cho phản ứng hóa học sau: \(S{O_2} + C{l_2} + 2{H_2}O \to {H_2}S{O_4} + 2HCl.\)Nhận xét đúng về vai trò của các chất tham gia phản ứng trên?
A. SO2 là chất oxi hóa, Cl2 là chất khử.
B. SO2 là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, SO2 là chất khử.
Câu hỏi 35 :
Trong tự nhiên clo có hai đồng vị bền \({}_{17}^{37}Cl,{}_{17}^{35}Cl\) . Nguyên tử khối trung bình của clo là 35,5. Thành phần trăm về khối lượng của 35Cl trong muối kali clorat KClO3 là bao nhiêu?
A. 7,25%.
B. 21,74%.
C. 28,98%.
D. 9,24%.
Câu hỏi 36 :
Ngâm một vật bằng đồng có khối lượng 4,24 gam vào 80 ml dung dịch AgNO3 CM. Phản ứng kết thúc lấy vật đồng ra khỏi dung dịch, rửa nhẹ, sấy khô; cân nặng 5 gam. Tính CM.
A. 0,225M
B. 0,125M
C. 0,345M
D. 0,25M
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK
