Hoá học 9 Bài 56: Ôn tập cuối năm
Tóm tắt bài
1.1. HÓA VÔ CƠ
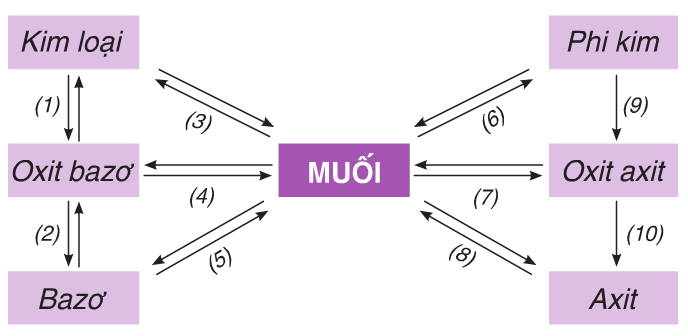
1.1.1. Mối quan hệ giữa các loại chất vô cơ
Hình 1: Mối quan hệ giữa các loại chất vô cơ
1.1.2. Vận dụng
Ví dụ 1: Viết phương trình phản ứng hoàn thành sơ đồ sau:
Hướng dẫn:
Fe + 2HCl → FeCl2 + H2
FeCl2 + Ag2SO4 → FeSO4 + 2AgCl↓
FeSO4 + Ba(NO3)2 → Fe(NO3)2 + BaSO4↓
Fe(NO3)2 + 2KOH → Fe(OH)2 + 2KNO3
Fe(OH)2 + O2 \(\overset{t^{0}}{\rightarrow}\) Fe2O3 + H2O
2Fe + 3Cl2 → 2FeCl3
2FeCl3 + 3Ag2SO4 → Fe2(SO4)3 + 6AgCl↓
Fe2(SO4)3 + 3Ba(NO3)2 → 2Fe(NO3)3 + 3BaSO4↓
Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO3
2Fe(OH)3 \(\overset{t^{0}}{\rightarrow}\) Fe2O3 + H2O
2FeCl2 (lục nhạt)+ Cl2 → 2FeCl3(vàng nâu)
2FeCl3 + Fe → 3FeCl2
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Fe2(SO4)3 + Fe \(\overset{t^{0}}{\rightarrow}\) 3FeSO4
4Fe(NO3)2 + O2 + 4HNO3 → 4Fe(NO3)3 + 2H2O
2Fe(NO3)3 + Cu → 2Fe(NO3)2 + Cu(NO3)2
4Fe(OH)2(trắng xanh) + O2 + 2H2O → 4Fe(OH)3(nâu đỏ)
Ví dụ 2: Hoàn thành các phản ứng sau:
Fe2(SO4)3 + ? → Fe(NO3)3 + ?
AlCl3 + ? → Al2(SO4)3 + ?
Al2O3 + KHSO4 → ? + ? + ?
KHCO3 + Ca(OH)2 → ? + ? + ?
NaCl + ? → NaOH + ?
Ca(HCO3)2 + ? → CaCO3↓ + ?
Hướng dẫn:
Fe2(SO4)3 + 3Ba(NO3)2 → 2Fe(NO3)3 + 3BaSO4↓
2AlCl3 + 3Ag2SO4 → Al2(SO4)3 + 6 AgCl↓
Al2O3 + 6KHSO4 → Al2(SO4)3 + 3K2SO4 + 3H2O
KHCO3 + Ca(OH)2 → CaCO3↓ + KOH + H2O
Điện phân có vách ngăn:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Ca(HCO3)2 +K2CO3 → CaCO3↓ + 2KHCO3
1.2. HÓA HỮU CƠ
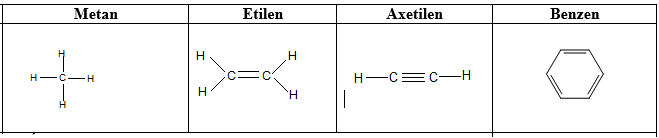
1.2.1. Công thức cấu tạo
Hình 2: Công thức cấu tạo của một vài chất hữu cơ
1.2.2. Tính chất hóa học
a) Rượu etylic, axit axetic, chất béo.
| Rượu etylic | Axit axetic | Chất béo | |
| Công thức | C2H5OH | CH3COOH | (RCOO)3C3H5 |
| Phản ứng đốt cháy | C2H5OH +3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 3H2O | CH3COOH + 3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 2H2O |
Chất béo (RCOO)3C3H5 + O2 \(\overset{t^{0}}{\rightarrow}\) CO2 + H2O |
| Phản ứng thủy phân | Không phản ứng | Không phản ứng |
Chất béo + Nước \(\overset{axit,t^{0}}{\rightarrow}\) Glixerin + các axit béo |
| Phản ứng với dung dịch kiềm | Không phản ứng | CH3COOH + NaOH → CH3COONa + H2O |
Chất béo + dd kiềm → Glixerin + Các muối của axit béo |
| Phản ứng với Na |
2C2H5OH + 2Na → 2C2H5ONa + H2 |
2 CH3COOH + 2Na → 2CH3COONa + H2 | Không phản ứng |
| Phản ứng este hóa |
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O |
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O | Không phản ứng |
| Tác dụng với muối của axit yếu hơn | Không phản ứng |
2 CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O |
Không phản ứng |
| Ứng dụng | Dùng làm rượu bia, nước giải khát, nhiên liệu, nguyên liệu điều chế các chất hữu cơ,… | Nguyên liệu để tổng hợp chất dẻo, phẩm nhuộm,dược phẩm,… | Là thành phần cơ bản trong thức ăn của người và động vật, cung cấp năng lượng,… |
b) Glucozơ, Saccarozơ, tinh bột và xenlulozơ
| Glucozơ | Saccarozơ | Tinh bột và xenlulozơ | |
| Công thức | C6H12O6 | C12H22O11 | (-C6H10O5-)n |
| Phản ứng Oxi hóa |
C6H12O6 + Ag2O\(\overset{NH_{3}}{\rightarrow}\) C6H12O7 + 2Ag. |
Không phản ứng | Không phản ứng |
| Phản ứng lên men |
C6H12O6 \(\overset{men\,\,giam}{\rightarrow}\)2C2H5OH + 2CO2 |
Không phản ứng | Không phản ứng |
| Phản ứng thủy phân | Không phản ứng | C12H22O11 + H2O \(\xrightarrow[t^{0}]{Axit}\) C6H12O6 + C6H12O6 | (–C6H10O5 –)n + nH2O \(\xrightarrow[t^{0}]{Axit}\) nC6H12O6 |
| Phản ứng với iot | Không phản ứng | Không phản ứng | tạo màu xanh tím |
Bài 1:
Nêu phương pháp tách hỗn hợp gồm MgO, Fe2O3, CuO ở thể rắn thành các chất nguyên chất.
Hướng dẫn:
Trước tiên ta sẽ khử các oxit kim loại trên bằng hiđro ở nhiệt độ cao (chỉ có oxit kim loại đứng sau nhôm mới bị khử)
Ta có phản ứng khử như sau: CuO + H2 → Cu + H2O; Fe2O3 + 3H2 → 2Fe + 3H2O
Còn lại MgO không bị khử. Sau đó ta cho các chất thu được tác dụng với axit HCl thì Cu không phản ứng và bị oxi hóa ở ngoài không khí tạo thành CuO:
2Cu + O2 → 2CuO. Ta tách được CuO ra khỏi hỗn hợp.
MgO + 2HCl → MgCl2 + H2 ; Fe + 2HCl → FeCl2 + H2
Hai muối thu được là MgCl2 và FeCl2 ta cho điện phân dung dịch thì FeCl2 bị điện phân tạo thành Fe, sau đó Fe bị oxi hóa thành Fe2O3 ta tách được Fe2O3
Muối MgCl2 không bị điện phân dung dịch thì ta điện phân nóng chảy tạo thành Mg, sau đó đốt nóng thì Mg bốc cháy trong không khí tạo ra MgO
MgCl2 → Mg + Cl2; 2Mg + O2 → 2MgO
Cuối cùng ta tách được cả ba chất trên ra khỏi hỗn hợp thành các chất nguyên chất.
Bài 2:
Hỗn hợp 3 kim loại Fe, Al, Cu nặng 17,4 gam. Nếu hòa tan hỗn hợp bằng axit H2SO4 loãng dư thì thoát ra 8,96 dm3 H2 (ở đktc). Còn nếu hòa tan hỗn hợp bằng axit đặc nóng, dư thì thoát ra 12,32 dm3 SO2 (ở đktc). Tính khối lượng mỗi kim loại ban đầu.
Hướng dẫn:
Cu không tan trong H2SO4 loãng, chỉ có Fe và Al tan được trong axit loãng
Fe + H2SO4 → FeSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
H2SO4 đặc nóng hòa tan cả 3 kim loại:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Số mol H2 = 0,4; số mol SO2 = 0,55
Gọi số mol của Fe, Al, Cu lần lượt là x, y, z ta có :
\(\left\{ \begin{array}{l} 56x{\rm{ }} + {\rm{ }}27y{\rm{ }} + {\rm{ }}64z{\rm{ }} = {\rm{ }}17,4\\ x{\rm{ }} + {\rm{ }}1,5y = 0,4\\ 1,5x{\rm{ }} + {\rm{ }}1,5y{\rm{ }} + {\rm{ }}z{\rm{ }} = {\rm{ }}0,55 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,1(mol)\\ y = 0,2(mol)\\ z = 0,1(mol) \end{array} \right.\)
Khối lượng của sắt ban đầu là: mFe = 0,1. 56 = 5,6 (gam)
Khối lượng của nhôm ban đầu là: mAl = 0,2. 27 = 5,4 (gam)
Khối lượng của đồng ban đầu là: mCu = 0,1. 64 = 6,4 (gam)
Bài 3:
Đốt cháy hoàn toàn 0,295 gam chất hữu cơ X chứa C, H, O thu được 0,44 gam CO2, 0,225 gam H2O. Trong một thí nghiệm khác, khi phân tích một lượng chất X như trên cho 55,8 cm3 N2 (đo ở đktc). Tỉ khối hơi của X so với H2 là 29,5. Lập CTHH và CTPT của X.
Hướng dẫn:
MX = 59. Đặt CTPT của X là CxHyOzNt
Áp dụng công thức: \(\frac{{{M_X}}}{{{m_X}}} = \frac{{44x}}{{{m_{C{O_2}}}}} = \frac{y}{{{m_{{H_2}O}}}} = \frac{{11,2t}}{{{V_{{N_2}}}}}\)
\(\frac{{59}}{{0,295}} = \frac{{44x}}{{0,44}} = \frac{y}{{0,225}} = \frac{{11,2t}}{{0,0558}}\)
=> x = 2; y = 5; t = 1
Với MA = 59 => z = 1. Vậy CTPT: C2H5ON
3. Luyện tập Bài 56 Hóa học 9
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 56 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Chọn câu đúng.
- A. Metan, etilen, axetilen đều làm mất màu dung dịch brom.
- B. Etilen, axetilen, benzen đều làm mất màu dung dịch brom.
- C. Etilen, axetilen đều làm mất màu dung dịch brom.
- D. Metan, etilen, benzen đều làm mất màu dung dịch brom.
-
- A. C2H2.
- B. C2H4.
- C. C2H6.
- D. C6H6.
-
- A. saccarozơ và tinh bột.
- B. glucozơ và xenlulozơ
- C. glucozơ và saccarozơ
- D. saccarozơ và xenlulozơ.
-
- A. CH3COOH, (-C6H10O5-)n.
- B. CH3COOC2H5 , C2H5OH.
- C. CH3COOH , C2H5OH
- D. CH3COOH, CH3COOC2H5.
-
- A. tinh bột, xenlulozơ, PVC, glucozơ.
- B. tinh bột, xenlulozơ, saccarozơ, chất béo.
- C. tinh bột, xenlulozơ, saccarozơ, glucozơ.
- D. tinh bột, xenlulozơ, saccarozơ, PE.
-
- A. Chất béo, glucozơ, tinh bột, xenlulozơ, saccarozơ
- B. Saccarozơ, glucozơ, tinh bột, xenlulozơ, chất béo
- C. Saccarozơ, glucozơ, tinh bột, chất béo, xenlulozơ
- D. Saccarozơ, glucozơ, chất béo, xenlulozơ, tinh bột
-
- A. 1,38 g
- B. 2,76 g
- C. 27,6 g
- D. 13,8 g
Câu 4- Câu 10: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 56.
Bài tập 1 trang 167 SGK Hóa học 9
Bài tập 2 trang 167 SGK Hóa học 9
Bài tập 3 trang 167 SGK Hóa học 9
Bài tập 4 trang 167 SGK Hóa học 9
Bài tập 5 trang 167 SGK Hóa học 9
Bài tập 1 trang 168 SGK Hóa học 9
Bài tập 2 trang 168 SGK Hóa học 9
Bài tập 3 trang 168 SGK Hóa học 9
Bài tập 4 trang 168 SGK Hóa học 9
Bài tập 5 trang 168 SGK Hóa học 9
Bài tập 6 trang 168 SGK Hóa học 9
Bài tập 7 trang 168 SGK Hóa học 9
4. Hỏi đáp về Bài 56 chương 5 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK