Sử dụng cửa sổ Open – local của phần mềm Yenka nghiên cứu về mưa acid
Câu hỏi :
Sử dụng cửa sổ Open – local của phần mềm Yenka nghiên cứu về mưa acid (theo hình hướng dẫn sau). Rút ra kết luận từ kết quả thí nghiệm.
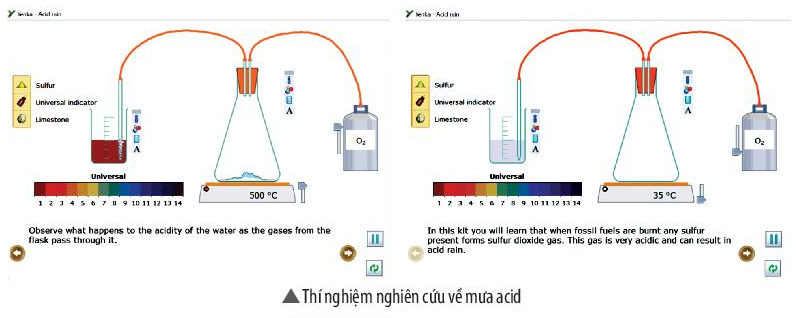
Sử dụng cửa sổ Open – local của phần mềm Yenka nghiên cứu về mưa acid (theo hình hướng dẫn sau). Rút ra kết luận từ kết quả thí nghiệm.

* Đáp án
* Hướng dẫn giải
Bước 1: Nhấp chuột vào thể Open – local, chọn Acids, Bases and Salts → Acid rain, mô phỏng đã được thiết kế xuất hiện ở màn hình.
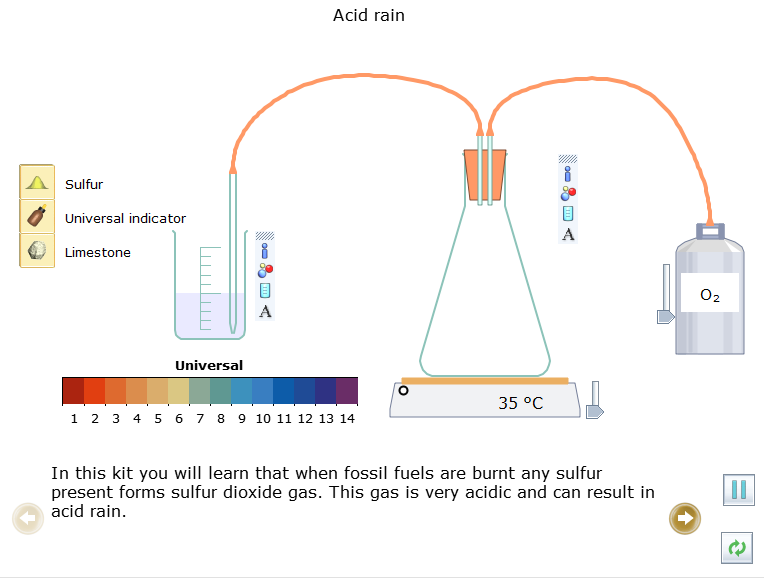
Trong thí nghiệm này em sẽ được hiểu rằng khi nhiên liệu hóa thạch bị đốt cháy thì sulfur (lưu huỳnh) sẽ chuyển thành khí sulfur dioxide (SO2). Khí này có tính acid rất cao và có thể dẫn đến mưa acid.
Bước 2: Nhấp chuột vào Next page  để thực hiện theo hướng dẫn.
để thực hiện theo hướng dẫn.
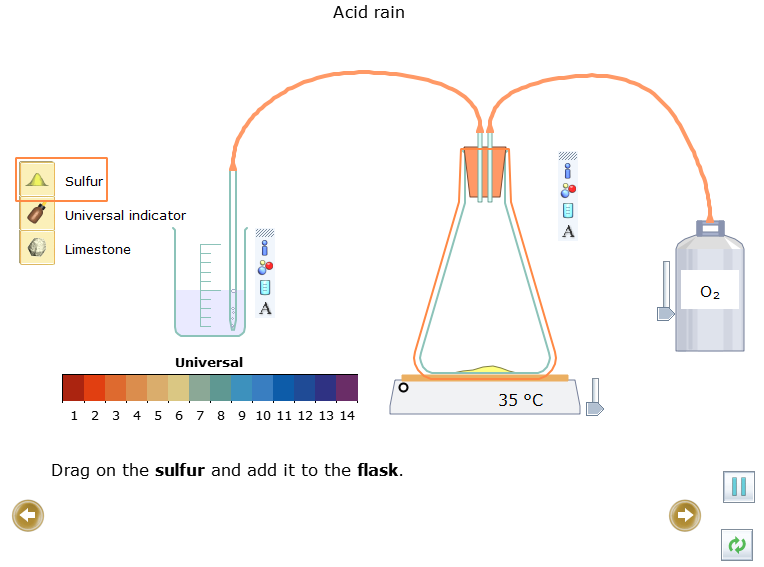
- Kéo Sulfur ![]() rồi thêm vào bình
rồi thêm vào bình
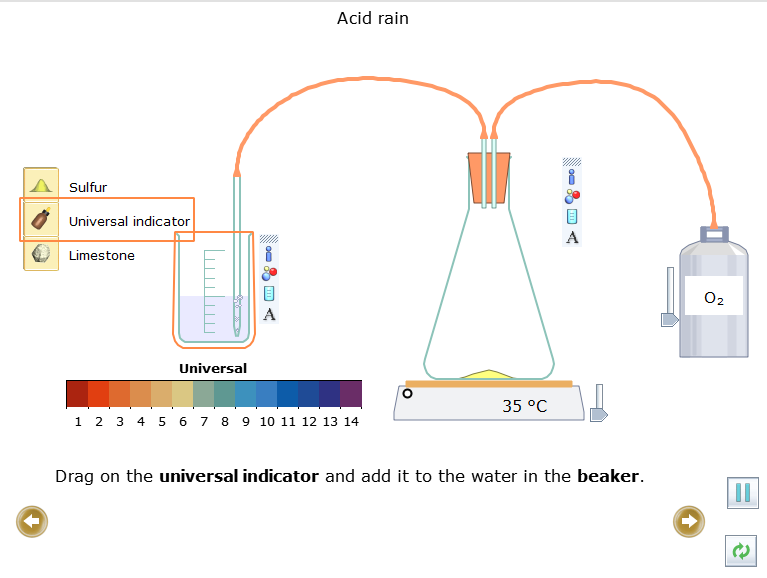
- Kéo ![]() (chỉ thị vạn năng) và thêm nó vào nước trong cốc.
(chỉ thị vạn năng) và thêm nó vào nước trong cốc.
- Bật bình khí oxygen bằng cách kéo thanh trượt lên trên
- Kéo tay cầm của thanh trượt trên bếp điện lên trên, cho đến khi sulfur bắt đầu đốt cháy.
- Quan sát điều gì xảy ra với tính acid của nước khi các khí từ bình đi qua nó.
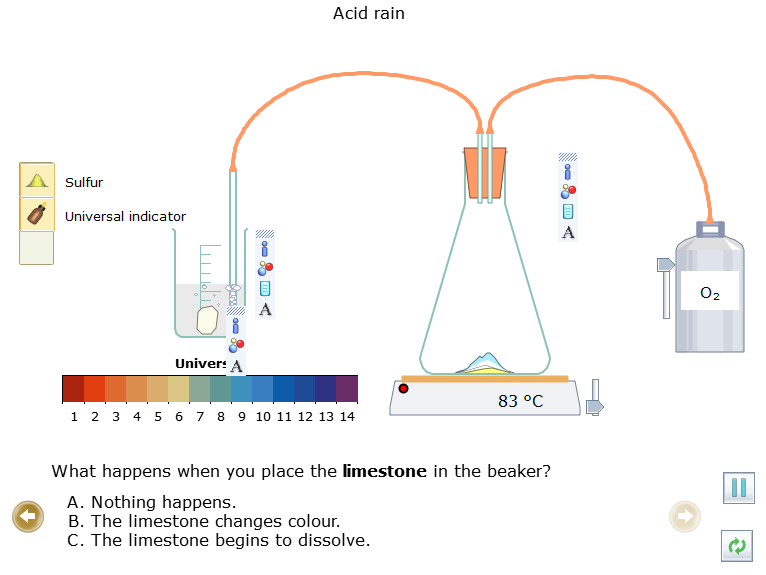
- Kéo đá vôi ![]() vào cốc, quan sát hiện tượng xảy ra.
vào cốc, quan sát hiện tượng xảy ra.
Bước 3: Ghi lại kết quả thí nghiệm và nhận xét
- Kết quả thí nghiệm:
+ Sulfur cháy trong oxygen với ngọn lửa màu xanh sáng.
+ Có khí thoát ra được dẫn vào cốc nước.
+ Khí này làm dung dịch trong cốc chuyển thành màu đỏ nhạt
+ Cho đá vôi vào dung dịch trong cốc thấy đá vôi tan, dung dịch từ màu đỏ chuyển thành không màu. Có khí thoát ra từ cốc.
- Nhận xét:
+ Sulfur cháy trong oxygen mãnh liệt với ngọn lửa màu xanh sáng tạo khí sulfur dioxide. Phương trình hóa học:
S(s) + O2(g) SO2(g)
+ Khí SO2 tan trong nước tạo dung dịch làm chỉ thị chuyển thành màu đỏ nhạt. Do có SO2 phản ứng với nước tạo H2SO3. H2SO3 có tính acid.
SO2 + H2O H2SO3
+ Cho đá vôi vào cốc có khí thoát ra từ cốc do có phản ứng:
CaCO3 + H2SO3 → CaSO3↓ + H2O + CO2↑
Acid phản ứng hết tạo môi trường trung tính.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Chuyên đề Hóa 10 Bài 9: Thực hành thí nghiệm hóa học ảo có đáp án !!
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK
