Hoá học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Tóm tắt bài
1.1. Dãy hoạt động hoá học của kim loại được xây dưng như thế nào?
1.1.1. Thí nghiệm 1
- Cho đinh Sắt vào dung dịch CuSO4
- Cho mẩu Đồng vào dung dịch FeSO4
Video 1: Phản ứng giữa Fe và dung dịch CuSO4
|
Thí nghiệm |
Tiến hành |
Hiện tượng + Phương trình hóa học |
|
Ống nghiệm 1 |
Cho đinh sắt vào dd CuSO4 |
Có chất rắn màu đỏ bám ngoài đinh sắt: Fe + CuSO4 → FeSO4 + Cu |
|
Ống nghiệm 2 |
Cho dây đồng vào dd FeSO4 |
Không có hiện tượng xảy ra |
-
Kết luận: Fe hoạt động hóa học mạnh hơn Cu
1.1.2. Thí nghiệm 2
-
Cho dây đồng vào dd AgNO3
-
Cho dây bạc vào dd CuSO4
Video 2: Phản ứng của dây đồng với dd AgNO3
|
Thí nghiệm |
Tiến hành |
Hiện tượng + Phương trình hóa học |
|
Ống nghiệm 1 |
Cho dây đồng vào dd AgNO3 |
Có chất rắn màu xám bám ngoài dây đồng Cu + 2AgNO3→ Cu(NO3)2 + 2Ag |
|
Ống nghiệm 2 |
Cho dây bạc vào dd CuSO4 |
Không có hiện tượng xảy ra |
- Kết luận: Cu hoạt động hóa học mạnh hơn Ag
1.1.3. Thí nghiệm 3
-
Cho đinh sắt vào dd HCl
-
Cho dây đồng vào dd HCl
Video 3: Phản ứng của đinh Sắt và dung dịch HCl
|
Thí nghiệm |
Tiến hành |
Hiện tượng + Phương trình hóa học |
|
Ống nghiệm1 |
Cho đinh sắt vào dd HCl |
Có bọt khí thoát ra, sắt tan dần Fe + 2HCl → FeCl2 + H2 |
|
Ống nghiệm 2 |
Cho dây đồng vào dd HCl |
Không có hiện tượng xảy ra |
- Kết luận: Fe đẩy được Hiđro ra khỏi dd axit, Cu không đẩy được Hiđro ra khỏi dd axit
1.1.4. Thí nghiệm 4
Video 4: Phản ứng của Natri và nước
|
Thí nghiệm |
Tiến hành |
Hiện tượng + Phương trình hóa học |
|
Cốc 1 |
Cho mẩu kim loại Natri vào nước có giấy tẩm phenolphtalein |
Mẩu Na tan dần, giấy có màu đỏ, có khí bay lên 2Na + 2H2O → 2NaOH + H2 |
|
Cốc 2 |
Cho đinh sắt vào nước có giấy tẩm phenolphtalein |
Không hiện tượng gì xảy ra |
- Kết luận: Na hoạt động hóa học mạnh hơn Fe
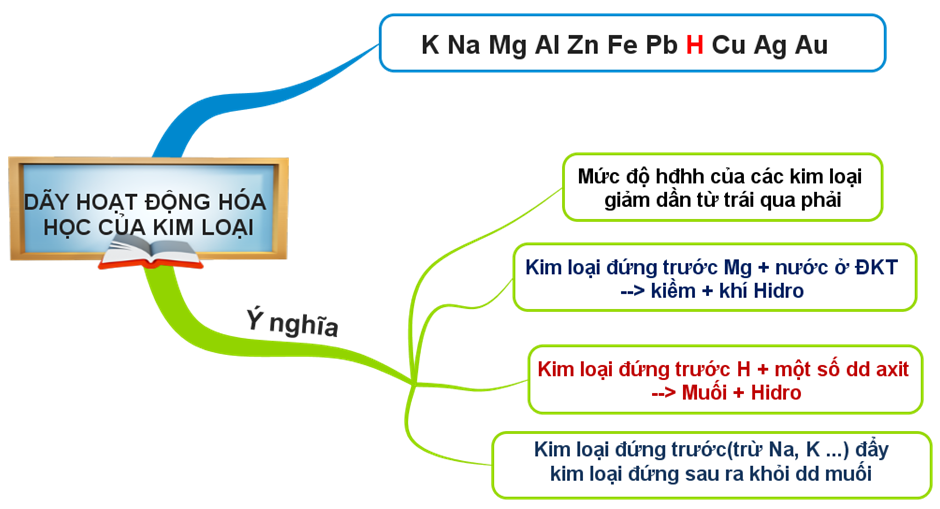
- Dãy hoạt động hóa học của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
1.2. Dãy hoạt động hóa học của kim loại có ý nghĩa như thế nào?
(1). Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
(2). Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí hiđro.
2Na + 2H2O → 2NaOH + H2
(3). Kim loại đứng trước H phản ứng với một số axit (HCl, H2SO4 loãng …) giải phóng khí H2
Fe + 2HCl → FeCl2 + H2
(4). Kim loại đứng trước (trừ K, Na..) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
1.3. Tổng kết
Hình 1: Sơ đồ tư duy bài Dãy hoạt động hóa học của kim loại
Bài 1:
Hoà tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng dung dịch H2SO4 loãng dư thấy thu được 4,48 lít H2 (đktc). Phần trăm số mol của Mg trong hỗn hợp là:
Hướng dẫn:
Gọi số mol của Mg và Zn lần lượt là x và y (mol)
Ta có phương trình phản ứng như sau:
Mg + H2SO4 → MgSO4 + H2
x → x
Zn + H2SO4 → ZnSO4 + H2
y → y
Ta có khối lượng hỗn hợp Mg và Zn là 8,9 gam nên: 24x + 65y = 8,9
Mặt khác, sau phản ứng thu được 4,48 lít khí nên:
\(\left\{ \begin{array}{l} 24x + 65y = 8,9\\ x + y = \frac{{4,48}}{{22,4}} = 0,2 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,1\\ y = 0,1 \end{array} \right.\)
Phần trăm số mol của Mg trong hỗn hợp là 50% (vì hai số mol của Mg và Zn bằng nhau)
3. Luyện tập Bài 17 Hóa học 9
Sau bài học cần nắm:
- Vận dụng ý nghĩa dãy hoạt động hoá học của kim loại để dự đoán kết quả phản ứng của kim loại cụ thể với dd axit, với nước và với dd muối.
- Tính khối lượng của kim loại trong phản ứng, thành phần phần trăm về khối lượng của hỗn hợp 2 Kim loại.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 17 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. ZnSO4
- B. Na2SO4
- C. MgSO4
- D. K2SO4
-
- A. Al
- B. Fe
- C. Cu
- D. Zn
-
- A. Na, Mg, Zn
- B. Al, Zn, Na
- C. Mg, Al, Na
- D. Pb, Ag, Mg
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 17.
Bài tập 4 trang 54 SGK Hóa học 9
Bài tập 5 trang 54 SGK Hóa học 9
Bài tập 15.5 trang 18 SBT Hóa học 9
Bài tập 15.9 trang 19 SBT Hóa học 9
Bài tập 15.11 trang 20 SBT Hóa học 9
Bài tập 15.12 trang 20 SBT Hóa học 9
Bài tập 15.13 trang 20 SBT Hóa học 9
Bài tập 15.17 trang 20 SBT Hóa học 9
Bài tập 15.18 trang 20 SBT Hóa học 9
Bài tập 15.19 trang 20 SBT Hóa học 9
Bài tập 15.20 trang 21 SBT Hóa học 9
Bài tập 15.21 trang 21 SBT Hóa học 9
4. Hỏi đáp về Bài 17 chương 2 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK