Hoá học 8 Bài 36 Nước
Tóm tắt bài
1.1. Thành phần hoá học của nước
1.1.1. Sự phân huỷ nước
Thí nghiệm
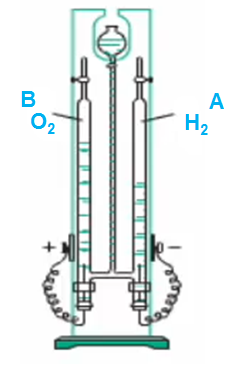
- Lắp thiết bị điện phân nước (pha thêm 1 ít dung dịch NaOH vào nước)
Hình 1: Phân hủy nước bằng dòng điện
Video 1: Phân hủy nước bằng dòng điện
Nhận xét
- Trước khi dòng điện một chiều chạy qua mực nước ở hai cột A,B bằng nhau.
-
Sau khi cho dòng điện một chiều qua, trên bề mặt điện cực xuất hiện bọt khí. Cực (-) cột A bọt khí nhiều hơn.
-
Vkhí B = Vkhí A
-
Khí ở cột B(+) làm que đóm bùng cháy; ở cột B(-) khí cháy được với ngọn lửa màu xanh.
-
Khí thu được là H2 (-) và O2 (+)
-
PTHH:
1.1.2. Sự tổng hợp nước
Thí nghiệm
-
Các bước tiến hành thí nghiệm
-
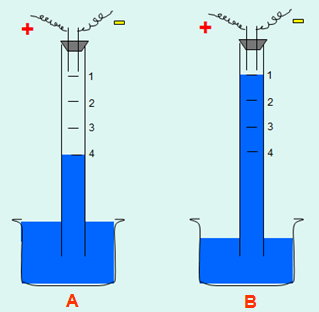
Bước 1: Cho nước vào đầy ống thủy tinh hình trụ.
-
Bước 2: Cho lần lượt 2 thể tích khí Hiđro và 2 thể tích khí Oxi. Mực nước trong ống ở vạch số 4.
-
Bước 3: Đốt bằng tia lửa điện, hỗn hợp H2 và O2 sẽ nổ
-
Bước 4: Đốt lượng khí dư sinh ra
-
Hình 1: Tổng hợp nước
a) Trước khi nổ b) Sau khi nổ
Nhận xét
- Sau khi đốt bằng tia lửa điện, hỗn hợp gồm 4 thể tích H2 và O2 chỉ còn 1 thể tích O2.
- Hỗn hợp H2 và O2 nổ. Mực nước trong ống dâng lên.
-
Mực nước dâng lên, dừng lại ở vạch số 1 →Tàn đóm bùng cháy.
-
Vậy khí còn dư là oxi. Còn dư chất khí.
-
Phương trình hóa học: 2H2 + O2
2H2O
-
* Xác định công thức phân tử của Nước
Phương trình hóa học: 2H2 + O2 .PNG)
Theo phương trình hóa học:
Cứ 1 mol O2 cần 2 mol H2.
Tỉ lệ:
⇒ %O = 100% - 11,1% = 88,9%
2 nguyên tố: H và O.
Tỉ lệ hoá hợp:
Công thức hóa học: H2O
Kết luận
- Nước là hợp chất tạo bởi hai nguyên tố là hiđro và oxi. Chúng đã hóa hợp với nhau:
- Theo tỉ lệ thể tích là hai phần khí Hiđro và một phần khí oxi.
- Theo tỉ lệ khối lượng là 1 một hiđro và 8 phần oxi hoặc 2 phần hiđro có một nguyên tử Oxi.
- Như vậy bằng thực nhiệm người ta cũng tìm ra công thức hóa học của nước là H2O
1.2. Tính chất của nước
1.2.1. Tính chất vật lí
Nước là chất lỏng, không màu, không mùi và không vị, sôi ở 1000C. Hoà tan nhiều chất: rắn, lỏng, khí…
1.2.2. Tính chất hóa học
Tác dụng với kim loại
- Cách tiến hành: Các em quan sát thao tác tiến hành cũng như hiện tượng phản ứng trong đoạn video sau
Video 1: Natri phản ứng với nước
- Hiện tượng: Miếng Na chạy nhanh trên mặt nước (nóng chảy thành giọt tròn). Có khí thoát ra, khi cho khí qua ngọn nến, nến tắt. Dung dịch sau phản ứng làm dung dịch phenolphtalein chuyển thành màu hồng.
- Giải thích: Natri phản ứng với nước theo phương trình hóa học 2Na + 2H2O → 2NaOH + H2
Khí không màu sinh ra là khí Hiđro. Khí H2 là khí không duy trì sự sống và sự cháy nên làm ngọn nến vụt tắt. Dung dịch tạo thành là dung dịch bazơ mạnh nên dung dịch phenolphtalein chuyển thành màu hồng.
- Kết luận: Nước có thể tác dụng với một số kim loại ở nhiệt độ thường: Na, K.
Hình 2: Phản ứng của Liti, Kali với nước
a) Liti phản ứng với nước ở nhiệt độ thường
b) Kali phản ứng với nước ở nhiệt độ thường
Tác dụng với một số oxit bazơ
- Cách tiến hành: Các em quan sát thao tác tiến hành cũng như hiện tượng phản ứng trong đoạn video sau
Video 2: Phản ứng của vôi sống CaO với nước
- Hiện tượng: CaO ở dạng rắn chuyển sang nhão, phản ứng tỏa nhiệt. Phenolphtalein chuyển thành màu hồng.
- Giải thích: CaO tác dụng với nước tạo dung dịch bazơ, làm Phenolphtalein chuyển thành màu hồng.
- Phương trình hóa học: CaO +H2O → Ca(OH)2
- Kết luận:
- Nước có thể hóa hợp với Na2O, K2O để tạo dung dịch Natri hiđroxit NaOH, Kali hiđroxit KOH ...
- Hợp chất do oxit bazơ hóa hợp với nước thuộc loại bazơ. Dung dịch bazơ làm quý hóa xanh, dung dịch phenolphtalein hóa hồng.
Tác dụng với một số oxit axit
- Cách tiến hành: Các em quan sát thao tác tiến hành cũng như hiện tượng phản ứng trong đoạn video sau. Đốt P trong bình oxi → rót một ít nước vào bình đựng P2O5 → lắc đều → Nhúng quì tím vào dung dịch thu được.
Video 3: Phản ứng giữa P2O5 và nước
- Hiện tượng: P2O5 tan trong nước. Dung dịch quì tím hoá đỏ (hồng).
- Giải thích: Do xảy ra phản ứng giữa P2O5 + 3H2O → 2H3PO4 (axit)
- Kết luận:
- Nước cũng hóa hợp với nhiều oxit axit khác như SO2, SO3, N2O5 ...
- Hợp chất tạo thành do nước hóa hợp với oxit axit thuộc loại axit. Dung dịch axit làm đổi màu quỳ tím thành đỏ.
1.3. Vai trò của nước trong đời sống và sản xuất. Chống ô nhiễm nguồn nước.
- Nước hòa tan nhiều chất dinh dưỡng cần thiết cho cơ thể sống. Nước cũng tham gia vào nhiều quá trình hóa học quan trọng trong cơ thể người và động vật. Nước rất cần thiết cho đời sống hằng ngày, sản xuất công nghiệp, xây dựng, giao thông vận tải...
Hình 3: Vai trò của nước trong đời sống
- Mỗi người cần góp phần giữ cho nguồn nước không bị ô nhiễm: Không vứt rác thải xuống ao, hồ, kênh rạch, sông; phải xử lí nước thải sinh hoạt và nước thải công nghiệp trước khi cho nước thải chảy vào hồ, sông, biển...
Hình 4: Chống ô nhiễm nguồn nước
1.4. Tổng kết
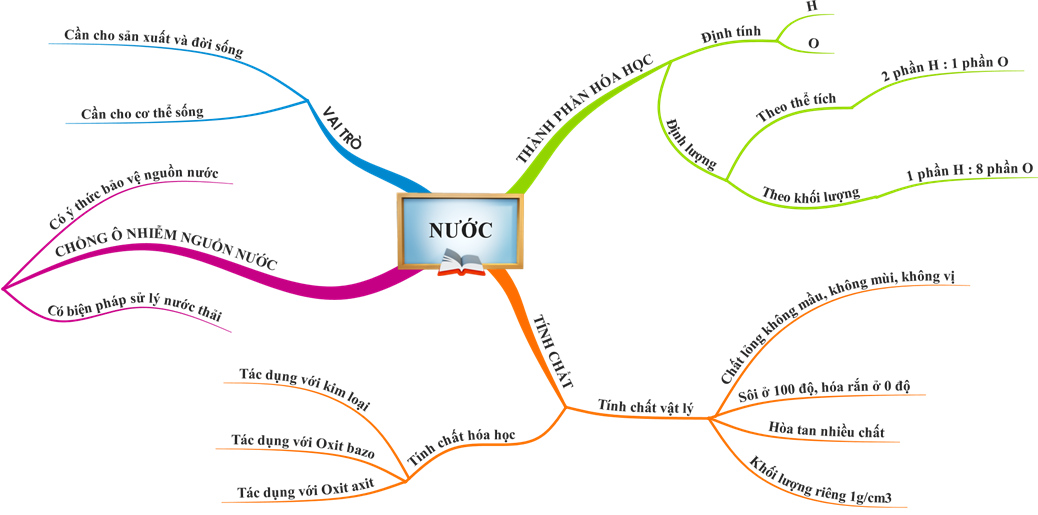
Hình 5: Sơ đồ tư duy bài Nước
Bài 1:
Đốt cháy hỗn hợp khí gồm 1,12 lit H2 và 1,68 lit O2 (đktc). Tính khối lượng nước tạo thành.
Hướng dẫn:
Số mol của Hiđro là: \({n_{{H_2}}} = \frac{{{V_{{H_2}}}}}{{22,4}} = \frac{{1,12}}{{22,4}} = 0,05(mol)\)
Số mol khí Oxi là: \({n_{{O_2}}} = \frac{{{V_{{O_2}}}}}{{22,4}} = \frac{{1,68}}{{22,4}} = 0,075(mol)\)
Để xác định chất nào dư ta lập tỉ lệ số mol của chất đó chia cho hệ số phản ứng. Nếu giá trì nào lớn hơn thì chất đó dư
\(\frac{{0,05}}{2} < \frac{{0,075}}{1}\) ⇒ Vậy Oxi còn dư, ta tính sản phẩm tạo thành theo số mol Hiđro
Phương trình hóa học:
2H2 + O2 .PNG)
2 mol 2 mol
0,05 mol → ? mol
Số mol nước tạo thành là: \({n_{{H_2}O}} = \frac{{2 \times 0,05}}{2} = 0,05(mol)\)
Khối lượng nước tạo thành là:
\({m_{{H_2}O}} = 0,05 \times (1 \times 2 + 16) = 0,9(g)\)
3. Luyện tập Bài 36 Hóa học 8
Sau bài học cần nắm:
- Nước có vai trò như thế nào?
- Có tính chất vật lí vật tính chất hóa học ra sao?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 36 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Hiđro và oxi
- B. Hiđro và nitơ
- C. Nitơ và Oxi
- D. Oxi và photpho
-
- A. 2 thể tích H và 3 thể tích O
- B. 2 thể tích H và 1 thể tích O
- C. 1 thể tích H và 2 thể tích O
- D. 3 thể tích H và 2 thể tích O
-
- A. 22,4 lit
- B. 11,2 lit
- C. 44,8 lit
- D. 8,96 lit
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 36.
Bài tập 6 trang 125 SGK Hóa học 8
Bài tập 36.1 trang 48 SBT Hóa học 8
Bài tập 36.2 trang 49 SBT Hóa học 8
Bài tập 36.3 trang 49 SBT Hóa học 8
Bài tập 36.4 trang 49 SBT Hóa học 8
Bài tập 36.5 trang 49 SBT Hóa học 8
Bài tập 36.6 trang 49 SBT Hóa học 8
Bài tập 36.7 trang 49 SBT Hóa học 8
Bài tập 36.8 trang 49 SBT Hóa học 8
Bài tập 36.9 trang 49 SBT Hóa học 8
Bài tập 36.10 trang 50 SBT Hóa học 8
Bài tập 36.11 trang 50 SBT Hóa học 8
4. Hỏi đáp về Bài 36 Chương 5 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK