Hoá học 8 Bài 33: Điều chế khí hiđro - Phản ứng thế
Tóm tắt bài
1.1. Điều chế H2
1.1.1. Trong phòng thí nghiệm
Cách tiến hành
- Nguyên liệu thường được dùng để điều chế H2 trong phòng thí nghiệm là axit HCl và kim loại Zn.
- Cho viên kẽm vào dung dịch axit HCl
Video 1: Phản ứng điều chế khí H2 từ phản ứng của Zn và Axit HCl
Hiện tượng - Giải thích
- Hiện tượng:
- Khi cho viên kẽm vào dung dịch axit HCl → dung dịch sôi lên và có khí thoát ra, viên kẽm tan dần.
- Sau khi phản ứng kết thúc, lấy 1-2 giọt dung dịch trong ống nghiệm đem cô cạn → thu được chất rắn màu trắng.
- Giải thích: Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2
Kết luận
- Để điều chế H2 trong phòng thí nghiệm người ta có thể thay dung dịch axit HCl bằng H2SO4 loãng và thay Zn bằng Fe, Al, …
- Ống nghiệm vừa tiến hành thí nghiệm nóng lên rất nhiều chứng tỏ phản ứng xảy ra là phản ứng toả nhiệt.
- Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách: Đẩy nước và đẩy không khí.
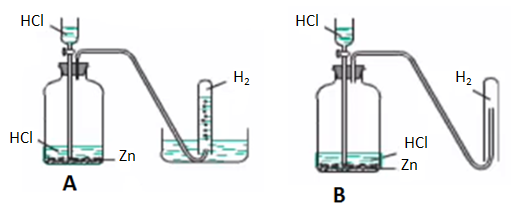
Hình 1: Phương pháp và điều chế khí Hiđro
A - Thu khí bằng phương pháp đẩy nước
B - Thu khí Hiđro bằng phương pháp đẩy không khí
- Khi thu O2 bằng cách đẩy không khí người ta phải chú ý để miệng bình hướng lên trên, vì O2 nặng hơn không khí.
- ⇒ Vậy khi thu H2 bằng cách đẩy không khí ta phải hướng miệng ống nghiệm xuống dưới vì khí H2 nhẹ hơn không khí.
1.1.2. Trong công nghiệp
Video 2: Thí nghiệm điện phân nước để điều chế Oxi, Hidro
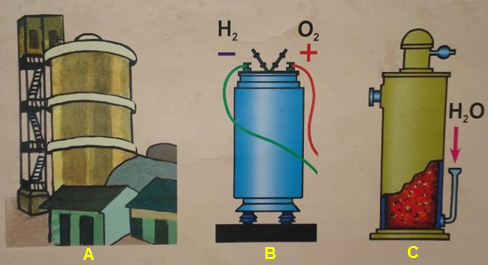
- Người ta điều chế H2 bằng cách điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí thiên nhiên, khí dầu mỏ
- Ví dụ:
Hình 2: Điều chế khí Hiđro trong công nghiệp
A) Từ thiên nhiên - khí dầu mỏ B) Điện phân nước C) Từ nước và than
1.2. Phản ứng thế là gì?
1.2.1. Ví dụ
- Phương trình phản ứng:
Zn + 2HCl → ZnCl2 + H2
(đơn chất) (hợp chất) (hợp chất) (đơn chất)
- Nhận xét: Nguyên tử Zn đã thay thế nguyên tử H trong hợp chất HCl
- Phương trình phản ứng:
-
Fe + H2SO4 → FeSO4 + H2
(đơn chất) (hợp chất) (hợp chất) (đơn chất)
- Nhận xét: Nguyên tử Fe đã thay thế nguyên tử H trong hợp chất H2SO4
1.2.2. Kết luận
- Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất.
1.3. Tổng kết
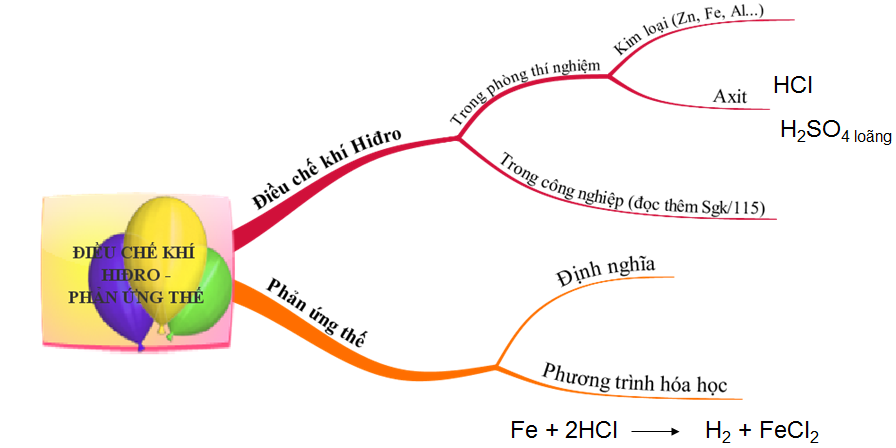
Hình 3: Sơ đồ tư duy bài Điều chế khí Hiđro - Phản ứng thế
Bài 1:
Trong những phản ứng sau, phản ứng nào là phản ứng thế ? Hãy giải thích sự lựa chọn đó?
a. 2Mg + O2 .PNG)
b. KMnO4 .PNG)
c. Fe + CuCl2 .PNG)
d. Mg(OH)2 .PNG)
e. Fe2O3 + H2 .PNG)
f. Cu + AgNO3 → Ag + Cu(NO3)2
Hướng dẫn:
Phản ứng thế là: c ; e ; g vì các nguyên tử của đơn chất (Fe , H2 , Cu) đã thay thế nguyên tử của 1 nguyên tố trong hợp chất (CuCl2 ; Fe2O3 ; AgNO3).
3. Luyện tập Bài 33 Hóa học 8
Sau bài học cần nắm:
- Cách điều chế H2 trong phòng thí nghiệm và trong công nghiệp
- Khái niệm phản ứng thế.
3.1. Trắc nghiệm
Trắc nghiệm Hóa học 8 Bài 33 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Cu + HCl
- B. CaO + H2O
- C. Fe + H2SO4
- D. CuO + HCl
-
- A. 1
- B. 2
- C. 3
- D. 4
-
- A. CuO + HCl → CuCl2 + H2O
- B. NaOH + HCl → NaCl + H2O
- C. Cu + 2FeCl3 → CuCl2 + 2FeCl2
- D. Fe + 2HCl → FeCl2 + H2
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 33.
Bài tập 33.1 trang 46 SBT Hóa học 8
Bài tập 33.2 trang 47 SBT Hóa học 8
Bài tập 33.3 trang 47 SBT Hóa học 8
Bài tập 33.4 trang 47 SBT Hóa học 8
Bài tập 33.5 trang 47 SBT Hóa học 8
Bài tập 33.6 trang 47 SBT Hóa học 8
Bài tập 33.7 trang 47 SBT Hóa học 8
Bài tập 33.8 trang 48 SBT Hóa học 8
Bài tập 33.9 trang 48 SBT Hóa học 8
Bài tập 33.10 trang 48 SBT Hóa học 8
Bài tập 33.11 trang 48 SBT Hóa học 8
Bài tập 33.12 trang 48 SBT Hóa học 8
4. Hỏi đáp về Bài 33 Chương 5 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK