Hoá học 11 Bài 38: Hệ thống hóa về hiđrocacbon
Tóm tắt bài
1.1. CTPT và đặc điểm cấu tạo của hidrocacbon
|
|
ANKAN |
ANKEN |
ANKIN |
ANKYLBENZEN |
|
1. CTPT |
CnH2n+2 (n ≥ 1) |
CnH2n (n ≥ 2) |
CnH2n - 2 (n ≥ 2) |
CnH2n - 6 (n ≥ 6) |
|
2. Đặc điểm cấu tạo |
- Chỉ có liên kết đơn. |
- Có 1 liên kết đôi C=C.
|
- Có một liên kết ba C≡C.
|
- Có vòng benzen.
|
|
3. Đồng phân |
- Mạch cacbon. |
- Mạch cacbon. - Vị trí liên kết đôi - Hình học. |
- Mạch cacbon. - Vị trí liên kết ba.
|
- Mạch cacbon của nhánh ankyl - Vị trí tương đối của các nhóm ankyl. |
|
4. Lí tính |
- Ở điều kiện thường; từ C1 đến C4 là chất khí, C5 đến C17 là chất lỏng và còn lại là chất rắn. - Không màu. - Không tan trong nước. - Nhiệt độ sôi, nhiệt độ nóng chảy tăng dần khi phân tử khối tăng. |
|||
1.2. TÍNH CHẤT HÓA HỌC CỦA HIDROCACBON
|
|
ANKAN |
ANKEN |
ANKIN |
ANKYLBENZEN |
|
Phản ứng thế |
Phản ứng thế với halogen |
|
Phản ứng thế bằng ion kim loại |
Phản ứng thế halogen, nitro hóa |
|
Phản ứng tách |
Phản ứng đehiđro hóa, crackinh |
|
|
|
|
Phản ứng cộng |
|
Phản ứng với halogen, HX, H2 |
Phản ứng với halogen, HX, H2 theo 2 giai đoạn |
Phản ứng với H2, Cl2 |
|
Phản ứng trùng hợp |
|
Phản ứng |
Phản ứng đime hóa, trime hóa |
|
|
Phản ứng oxi hóa không hoàn toàn (phản ứng với KMnO4) |
|
Phản ứng |
Phản ứng |
Benzen: không làm mất màu Ankylbenzen: làm mất màu khi đun nóng |
|
Phản ứng cháy |
nCO22O |
nCO2=nH2O |
nCO2>nH2O |
nCO2 > nH2O |
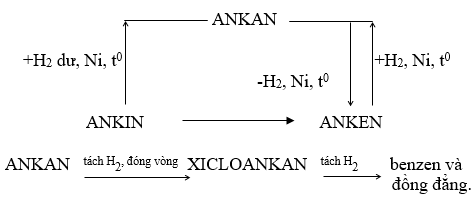
1.3. SỰ CHUYỂN HÓA GIỮA CÁC LOẠI HIDROCACBON
Hình: Sơ đồ chuyển hóa giữa các loại hidrocacbon
Bài 1:
Crackinh hoàn toàn V lít ankan X thu được hỗn hợp Y gồm 0,1V lít C3H8; 0,6V lít CH4; 1,8V lít các hidrocacbon khác. Tỉ khối của Y so với H2 là 14,4. Dẫn 1 mol Y đi qua bình chứa dung dịch Brom dư, phản ứng kết thúc thấy khối lượng bình tăng m gam. Biết các thể tích khí đo ở cùng điều kiện, chỉ có ankan tham gia phản ứng crackinh. Giá trị của m là:
Hướng dẫn:
Do tỉ lệ mol cũng bằng tỉ lệ thể tích ở cùng điều kiện nên nếu xét 1 mol Y
\(\Rightarrow n_Y = n_{C_3H_8} + n_{CH_4} + n_{HC khac} = 0,1n_X + 0,6n_X + 1,8n_X\)
⇒ nX = 0,4 mol
Bảo toàn khối lượng: mX = mY = 2 × 14,4 × 1 = 28,8 g
⇒ MX = 72 g ⇒ X là C5H12
Các phản ứng cracking xảy ra:
+/ C5H12 → CH4 + C4H8
+/ C5H12 → C3H8 + C2H4
+/ C5H12 → C2H6 + C3H6
+/ C3H8 → CH4 + C2H4 (*) ⇒ C5H12 → CH4 + 2C2H4
⇒ ở PT (*) có: \(n_{C_2H_4} = 2(n_Y - 2n_X )= 0,4\ mol\)
\(\Rightarrow n_{C_4H_8} = 0,04\ mol;\ n_{C_3H_8} = 0,04\ mol\)
\(\Rightarrow n_{C_2H_4} = 0,44\ mol \Rightarrow n_{HC\ khac} = n_{C_4H_8} + n_{C_2H_4} + n_{C_2H_6} + n_{C_3H_6}\)
\(\Rightarrow n_{C_2H_6} = n_{C_3H_6} = 0,12\ mol\)
⇒ Brom phản ứng được với C4H8; C3H6; C2H4.
⇒ mtăng \(= m_{C_4H_8} + m_{C_2H_4} + m_{C_3H_6} = 19,6\ g\)
Bài 2:
Cho hỗn hợp hai anken đồng đẳng kế tiếp nhau tác dụng với nước (có H2SO4 làm xúc tác) thu được hỗn hợp Z gồm hai rượu (ancol) X và Y. Đốt cháy hoàn toàn 1,06 gam hỗn hợp Z sau đó hấp thụ toàn bộ sản phẩm cháy vào 2 lít dung dịch NaOH 0,1M thu được dung dịch T trong đó nồng độ của NaOH bằng 0,05M. Công thức cấu tạo thu gọn của X và Y là (Cho: H = 1; C = 12; O = 16; thể tích dung dịch thay đổi không đáng kể)
Hướng dẫn:
Gọi CTPT trung bình 2 anken là \(C_{\bar{n}} H_{2\bar{n}}\)
(\(\Rightarrow\) ancol tương ứng \(C_{\bar{n}} H_{2\bar{n} +2}O\))
+ Đốt cháy: \(C_{\bar{n}} H_{2\bar{n}+2}O\ +\frac{3\bar{n}}{2}O_2\rightarrow \bar{n}CO_2+(\bar{n}+1)H_2O\)
+ Do sản phẩm cháy đi vào NaOH sau đó còn dư bazo nên CO2 tạo muối Na2CO3:
2NaOH + CO2 → Na2CO3 + H2O
\(\Rightarrow 0,5\times n_{NaOH \ pu} = n_{CO2} = 0,5\times 2\times (0,1 - 0,05) = 0,05\) (mol)
\(\Rightarrow C_{\bar{n}} H_{2\bar{n}+2}O=\frac{0,05}{\bar{n}}\) (mol)
\(\Rightarrow M_{C_{\bar{n}} H_{2\bar{n} +2}O}=14\bar{n}+18=\frac{1,06}{\frac{0,05}{\bar{n}}}\Rightarrow \bar{n}=2,5\)
\(\Rightarrow\) Mà 2 anken là đồng đẳng liên tiếp
\(\Rightarrow\) chúng là C2H5OH và C3H7OH
Bài 3:
Hấp thụ vừa đủ hỗn hợp khí X gồm etilen và propilen vào dung dịch KMnO4 31,6% ở nhiệt độ thấp thu được dung dịch Y chỉ chứa 3 chất tan là etilenglicol, propan-1-2-điol, kali hidroxit và kết tủa Z. Trong dung dịch Y nồng độ % của etilenglicol là 6,906%. Phần trăm hối lượng prpilen trong X là:
Hướng dẫn:
Gọi khối lượng anken hấp thụ là m g có x mol etilen và y mol propen.
⇒ m = 28x + 42y
Giả sử có 100g dung dịch thuốc tím ⇒ n\(\tiny KMnO_4\) = 0,2 mol
Các quá trình:
+ Cho e: anken → diol + 2e
+ Nhận e: MnO4- + 2H2O + 3e → MnO2 + 4OH-
⇒ n e trao đổi = 2x + 2y = 0,2 × 3 = 0,6 mol (1)
⇒ m rắn không tan = 17,4 g
⇒ m dd sau = m dd thuốc tím + m anken – m rắn = 82,6 + m
⇒ C% etilenglicol = \(\frac{62x}{82,6 +28x + 42y}\) = 0,06906 (2)
Từ 1 và 2 ⇒ x = 0,104 mol; y= 0,196 mol
%m propilen (X) = 73,75%
Bài 4:
Đốt cháy hoàn toàn 4,64 gam một hiđrocacbon X (chất khí ở điều kiện thường) rồi đem toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2. Sau các phản ứng thu được 39,4 gam kết tủa và khối lượng phần dung dịch giảm bớt 19,912 gam. Công thức phân tử của X là:
Hướng dẫn:
\(m_{\downarrow} = 39,4 \ gam\)
Khối lượng dung dịch giảm bớt 19,912 gam
\(\\ \Rightarrow m_{\downarrow} - (m_{CO_{2}} + m_{H_{2}O}) = 19,912 \\ \Rightarrow m_{CO_{2}} + m_{H_{2}O} = 19,488 \\ m_{C} + m_{H} = m_{hh} = 4,64 \\ X: C_{x}H_{y} \\ \left\{\begin{matrix} 12x+y = 4,64 \ \ \ \ \ \ \ \\ 44x + 18.\dfrac{y}{2} = 19,488 \end{matrix}\right. \Rightarrow \left\{\begin{matrix} x = 0,348 \\ y = 0,464 \end{matrix}\right. \\ x : y = 0,348:0,464 = 3:4 \Rightarrow C_{3}H_{4}\)
3. Luyện tập Bài 38 Hóa học 11
Sau bài học cần nắm:
- Hệ thống hóa kiến thức các hiđrocacbon quan trọng: ankan, anken, ankin và ankylbenzen về đặc điểm cấu tạo tính chất vật lý, tính chất hóa học, tính đặc trưng và ứng dụng.
- Viết phản ứng hóa học, chuyển hóa giữa các hidrocacbon nhận biết và điều chế chúng.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 38 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. C4H10.
- B. C2H2.
- C. C4H4.
- D. C4H6.
-
Câu 2:
Có bao nhiêu chất ứng với CTPT C4H8 mà khi hiđro hóa với xúc tác Ni nung nóng cho sản phẩm là butan?
- A. 4
- B. 6
- C. 5
- D. 3
-
- A. 2,2-dimetylpropan và 2-metylbutan.
- B. 2,2-dimetylpropan và pentan.
- C. 2-metylbutan và 2,2-dimetylpropan.
- D. 2-metylpropan và pentan.
-
- A. Dung dịch màu tím bị nhạt màu dần thành không màu.
- B. Dung dịch không màu chuyển sang màu tím.
- C. Màu tím của KMnO4 chuyển dần sang mầu xanh của C2H4(OH)2.
- D. Màu tím của KMnO4 chuyển dần sang không mầu và có vẩn đục màu đen.
-
Câu 5:
Cho hình vẽ mô tả thí nghiệm điều chế Y từ dung dịch X:
Hình vẽ trên minh họa phản ứng nào sau đây?- A. CH3COONa + HCl → CH3COOH + NaCl.
- B. CH3-CH2-OH (+ H2SO4, 170oC)→ CH2=CH2 + H2O.
- C. CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O.
- D. HCOONH4 + NaOH → HCOONa + H2O.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 38.
Bài tập 38.6 trang 60 SBT Hóa học 11
Bài tập 38.7 trang 60 SBT Hóa học 11
Bài tập 38.8 trang 60 SBT Hóa học 11
Bài tập 38.9 trang 60 SBT Hóa học 11
Bài tập 1 trang 207 SGK Hóa học 11 nâng cao
Bài tập 2 trang 207 SGK Hóa học 11 nâng cao
Bài tập 3 trang 207 SGK Hóa học 11 nâng cao
Bài tập 4 trang 207 SGK Hóa học 11 nâng cao
Bài tập 5 trang 207 SGK Hóa học 11 nâng cao
Bài tập 6 trang 207 SGK Hóa học 11 nâng cao
Bài tập 7 trang 207 SGK Hóa học 11 nâng cao
Bài tập 8 trang 207 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 38 Chương 7 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)