Hoá học 9 Bài 37 Etilen
Tóm tắt bài
2.1. Tính chất vật lí
- Etilen là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (\(d = \frac{{28}}{{29}}\))
2.2. Cấu tạo phân tử
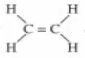
- Trong phân tử etilen, mỗi nguyên tử Cacbon liên kết với hai nguyên tử Hiđro, hai hóa trị còn lại liên kết hai nguyên tử Cacbon với nhau.
- Công thức cấu tạo của etilen:
- Công thức cấu tạo thu gọn: CH2 = CH2
-
Giữa 2 nguyên tử C có 2 liên kết, những liên kết như vậy gọi là liên kết đôi.
-
Trong liên kết đôi có một liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hoá học.
Hình 1: Mô hình phân tử Etilen
a) Mô hình rỗng b) Mô hình đặc
2.3. Tính chất hóa học
2.3.1. Etilen có cháy không?
Khi đốt etilen cháy tạo thành CO2, hơi nước vàng toả nhiều nhiệt
C2H4 +3 O2 .PNG)
Video 1: Đốt cháy etilen
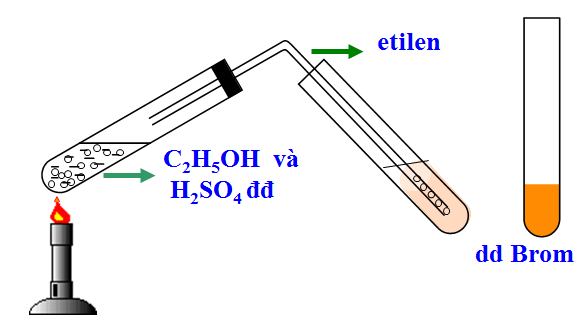
2.3.2. Etilen có làm mất màu dung dịch nước Brom hay không?
Hình 2: Thí nghiệm etilen tác dụng với dung dịch nước Brom
-
CH2=CH2 + Br2
Br-CH2-CH2-Br (đibrômetan)
-
Ngoài ra etilen còn có pứ cộng với 1 số chất khác như H2, Cl2.
-
Nhìn chung các chất có liên kết đôi (tương tự như etilen) dễ tham gia pứ cộng
Video 2: Phản ứng giữa etilen và dung dịch nước Brom
2.3.3. Các phân tử etilen có kết hợp được với nhau không?
...+ CH2 = CH2 + CH2 = CH2 + CH2 = CH2 +... 
- Các phân tử etilen kết hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn gọi là polietilen (PE)
- Phản ứng trên gọi là phản ứng trùng hợp
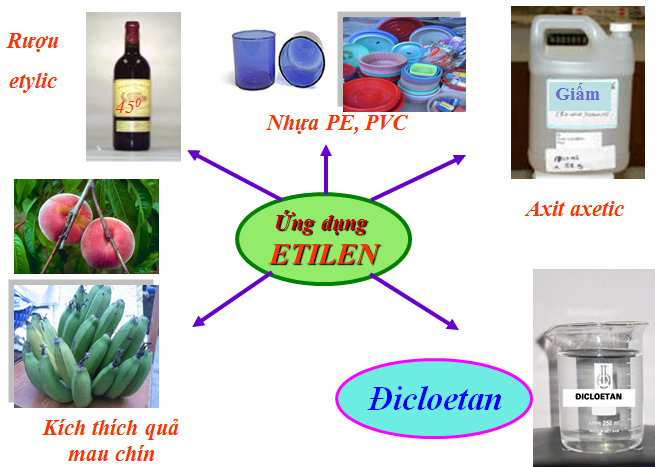
2.4. Ứng dụng
Hình 3: Ứng dụng của etilen
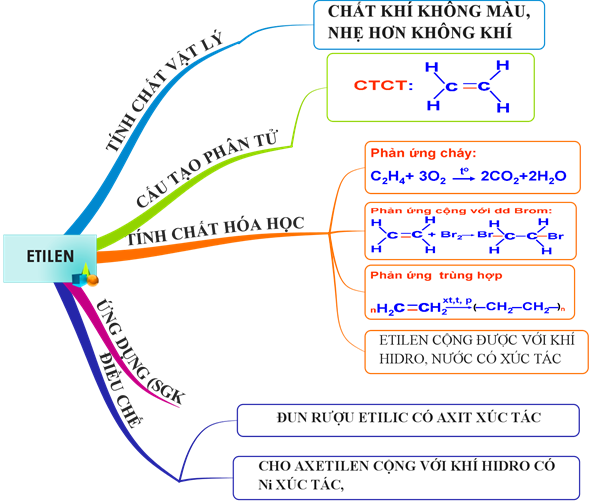
2.5. Tổng kết
Hình 4: Sơ đồ tư duy bài Etilen
Bài 1:
Có 3 lọ mất nhãn đựng riêng biệt các khí metan, etilen và cacbonic. Các thí nghiệm dùng để nhận biết từng chất khí trên được trình bày trong bảng sau. Hãy điền các dấu hiệu phân biệt các chất vào các ô trống trong bảng.
|
Chất Thí nghiệm |
Metan |
Etilen |
Cacbonic |
|
Cho từng khí lội qua dung dịch brom |
|
|
|
|
Cho từng khí lội qua dung dịch nước vôi trong |
|
|
|
Hướng dẫn:
|
Chất Thí nghiệm |
Metan |
Etilen |
Cacbonic |
|
Cho từng khí lội qua dung dịch brom |
- |
mất màu nâu của dd |
- |
|
Cho từng khí lội qua dung dịch nước vôi trong |
- |
- |
kết tủa trắng |
Bài 2:
Cho 4,48 lít hỗn hợp hai khí metan và etilen đi qua bình đựng dung dịch nước brom dư. Cân lại bình đựng dung dịch brom, thấy khối lượng tăng 1,4 gam. Biết thể tích khí đã cho ở đktc, thành phần phần trăm về thể tích của metan và etilen lần lượt là:
Hướng dẫn:
Chỉ có etilen phản ứng được với dung dịch nước brom. Như vậy khối lượng tăng lên chính là khối lượng của etilen.
Phương trình phản ứng: CH2=CH2 + Br2 → Br-CH2-CH2-Br
Số mol của etilen là:
\({n_{C{H_2} = C{H_2}}} = \frac{m}{M} = \frac{{1,4}}{{12 \times 2 + 1 \times 4}} = 0,05(mol)\)
Thể tích khí etilen là:
\({V_{C{H_2} = C{H_2}}} = 22,4 \times {n_{C{H_2} = C{H_2}}} = 22,4 \times 0,05 = 1,12(lit)\)
Thể tích khí metan là:
\({V_{C{H_4}}} = {V_{hh}} - {V_{C{H_2} = C{H_2}}} = 4,48 - 1,12 = 3,36(lit)\)
Thành phần % về thể tích của metan và etilen lần lượt là:
\(\begin{array}{l} \% {V_{C{H_4}}} = \frac{{{V_{C{H_4}}}}}{{{V_{hh}}}}.100 = \frac{{1,12}}{{4,48}}.100 = 25\% \\ \% {V_{C{H_2} = C{H_2}}} = 100\% - 25\% = 75\% \end{array}\)
4. Luyện tập Bài 37 Hóa học 9
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của êtilen.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, tỉ khối so với không khí. Tính chất hoá học của C2H4: Phản ứng cộng với dd Br2, pứ trùng hợp tạo PE, pứ cháy.
- Etylen được dùng làm nguyên liệu điều chế nhựa PE, ancol (rượu) etylic, axit axetic.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 37 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Một liên kết đơn
- B. Một liên kết đôi
- C. Một liên kết ba
- D. Hai liên kết đôi
-
- A. Tham gia phản ứng cộng với dd brom
- B. Tham gia phản ứng cộng với khí hidro
- C. Tham gia phản ứng trùng hợp
- D. Tham gia phản ứng cháy với oxi
-
- A. Dung dịch brom
- B. Dung dịch phenolphtalein
- C. Dung dịch nước vôi trong
- D. Dung dịch Natrihidroxit
-
- A. CH4
- B. CH3 – CH3
- C. CH3-CH2-OH
- D. CH2 = CH – CH3
-
- A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí
- B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí
- C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí
- D. Chất khí, không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 37.
Bài tập 1 trang 119 SGK Hóa học 9
Bài tập 2 trang 119 SGK Hóa học 9
Bài tập 3 trang 119 SGK Hóa học 9
Bài tập 4 trang 119 SGK Hóa học 9
5. Hỏi đáp về Bài 37 chương 4 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK