Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản
Câu hỏi :
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.
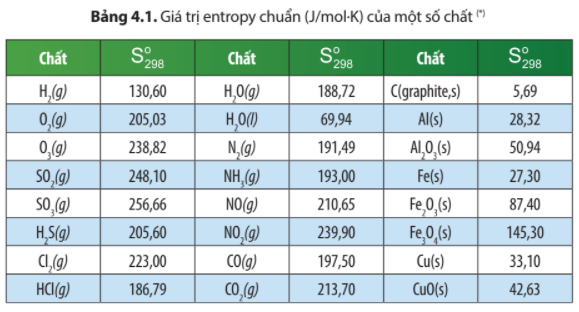
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.

* Đáp án
* Hướng dẫn giải
=
= × (O2, g) + (SO2, g) - (SO3, g)
= × 205,03 + 248,10 – 256,66 = 93,955 J/K > 0
⇒ Phản ứng phân hủy SO3 làm tăng độ mất trật tự của hệ.
Ở ví dụ 1, phản ứng tổng hợp SO3 có = -93,95 J/K < 0
⇒ Phản ứng làm giảm độ mất trật tự của hệ.
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Chuyên đề Hóa 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs có đáp án !!
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK
