Hoá học 12 Bài 31: Sắt
Tóm tắt bài
2.1. Vị trí trong Bảng tuần hoàn, cấu hình electron nguyên tử
- Cấu hình electron: 1s22s22p63s23p63d64s2 hay [Ar]3d64s2
- Ô thứ 26, nhóm VIIIB, chu kì 4
-
Sắt dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d để trở thành ion Fe3+.
2.2. Tính chất vật lí
Quan sát Con cá Sắt giúp ngăn ngừa bệnh thiếu máu 
- Sắt là kim loại màu trắng hơi xám
- Có khối lượng riêng lớn (d = 8,9 g/cm3), nóng chảy ở 15400C.
- Sắt có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ.
2.3. Tính chất hóa học
- Là kim loại có tính khử trung bình.
-
Với chất oxi hoá yếu: Fe → Fe2+ + 2e
-
Với chất oxi hoá mạnh: Fe → Fe3+ + 3e
-
a. Tác dụng với Phi kim
- Thí nghiệm: Sắt phản ứng với Lưu huỳnh: \(Fe+S\overset{t^{0}}{\rightarrow}FeS\)
- Thí nghiệm: Sắt cháy trong Oxi: \(Fe+O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
- Thí nghiệm: Sắt tác dụng với Clo: \(2Fe+3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
b. Tác dụng với axit
-
Với dung dịch HCl, H2SO4 loãng: Fe đưa về sắt (II), H+ chuyển thành H2
-
Thí nghiệm của Sắt trong dung dịch sunfuric loãng: \(Fe + H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\uparrow\)
-
-
- Với dung dịch HNO3 và H2SO4 đặc, nóng: Fe khử \(N^{+5}\) hoặc \(S^{+6}\) trong HNO3 hoặc H2SO4 đặc, nóng đến số oxi hoá thấp hơn, còn Fe bị oxi hoá thành \(Fe^{3+}\).
- Thí nghiệm: Sắt trong dung dịch HNO3 loãng: \(Fe+4HNO_{3}\rightarrow Fe(NO_{3})_{3}+NO\uparrow+2H_{2}O\)
- Lưu ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
c. Tác dụng với dung dịch muối
- Sắt có thể khử được các ion của các kim loại đứng sau nó trong dãy điện hóa.
- Thí nghiệm: Sắt phản ứng với dung dịch Đồng(II) sunfat \(Fe+CuSO_{4}\rightarrow FeSO_{4}+Cu\downarrow\)
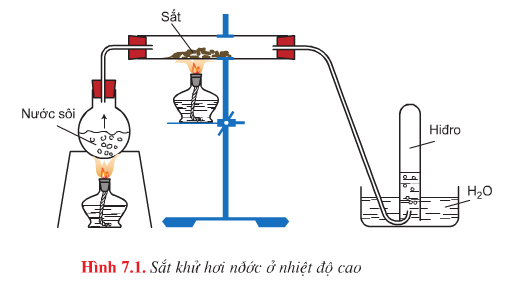
d. Tác dụng với nước
- Hình vẽ mô phỏng thí nghiệm: Sắt khử hơi nước ở nhiệt độ cao
- Phương trình hóa học:
- \(3Fe+4H_{2}O\overset{t^{0}<570^{0}C}{\rightarrow}Fe_{3}O_{4}+4H_{2}\uparrow\)
- \(Fe+H_{2}O\overset{t^{0}>570^{0}C}{\rightarrow}FeO+H_{2}\uparrow\)
2.4. Ứng dụng
-
Chiếm khoảng 5% khối lượng vỏ trái đất, đứng hàng thứ hai trong các kim loại (sau Al).
-
Trong tự nhiên sắt chủ yếu tồn tại dưới dạng hợp chất có trong các quặng:
-
quặng manhetit (Fe3O4)
-
quặng hematit đỏ (Fe2O3)
-
quặng hematit nâu (Fe2O3.nH2O)
-
quặng xiđerit (FeCO3)
-
quặng pirit (FeS2)
-
- Có trong hemoglobin (huyết cầu tố) của máu
- Có trong các thiên thạch.
3.1. Bài tập Sắt - Cơ bản
Bài 1:
Cho m gam kim loại Fe tác dụng với dung dịch HNO3 dư, sau phản ứng thu được 3,36 lít khí NO đo ở đktc (sản phẩm khử duy nhất). Giá trị m là:
Hướng dẫn:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,15 0,15
⇒ m Fe = 0,15. 56 = 8,4 gam
Bài 2:
Cho 4,368 gam bột Fe tác dụng với m gam bột S. Sau phản ứng được rắn X. Toàn bộ X tan hết trong dung dịch HNO3 loãng dư được sản phẩm khử duy nhất là 0,12 mol NO. Giá trị m là:
Hướng dẫn:
Coi hỗn hợp X gồm Fe và S phản ứng với HNO3
Fe → Fe3+ + 3e
S → S6+ + 6e
N5+ + 3e → N2+
Bảo toàn e: 3nFe + 6nS = 3nNO
⇒ nS = 0,021 mol
⇒ m = 0,672g
Bài 3:
Cho m gam Fe vào bình đựng dung dịch H2SO4 và HNO3 thu được dung dịch X và 1,12 lít khí NO. Thêm tiếp H2SO4 dư vào bình được 0,448 lít NO và dung dịch Y. Trong cả 2 trường hợp đều có NO là sản phẩm khử duy nhất ở kiện tiêu chuẩn. Dung dịch Y hòa tan vừa hết 2,08 gam Cu không tạo sản phẩm khử N+5. Các phản ứng đều hoàn toàn. Giá trị m là:
Hướng dẫn:
Tổng số mol khí NO sau các phản ứng là: 0,07 mol
Giả sử trong Y có Fe3+ và Fe2+
⇒ bảo toàn e: 3nFe3+ + 2nFe2+ = 3nNO
Lại có: 2Fe3+ + Cu → Cu2+ + 2Fe2+ (Y hòa tan Cu nhưng không có sản phẩm khử của N+5)
⇒ nFe3+ = 2nCu = 0,065 mol ⇒ nFe2+ = 0,0075 mol
⇒ m = 56.(0,065 + 0,0075) = 4,06g
Bài 4:
Cho 6,72 gam bột Fe tác dụng với 384 ml dung dịch AgNO3 1M sau khi phản ứng kết thúc thu được dung dịch A và m gam chất rắn. Dung dịch A tác dụng được với tối đa bao nhiêu gam bột Cu?
Hướng dẫn:
nFe = 0,12 mol; \(n_{AgNO_{3}}\) = 0,384 mol
Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
⇒ Dung dịch sau có: 0,12 mol Fe3+; 0,024 mol Ag+
⇒ 2nCu = nFe3+ + nAg+
⇒ nCu = 0,072 mol
⇒ mCu = 4,608g
3.2. Bài tập Sắt - Nâng cao
Bài 1:
Đốt cháy hỗn hợp gồm 2,4g Mg; 4,48g Fe với hỗn hợp X gồm có Cl2 và O2; sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không có khí dư). Hòa tan Y vào lượng vừa đủ 120 ml HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào Z thu được 61,01g kết tủa. Phần trăm V của O2 trong X là:
Hướng dẫn:
nMg = 0,1 mol; nFe = 0,08 và nHCl = 0,24.
\(\begin{matrix} Mg & - & 2e & \rightarrow & Mg^{2+}\\ 0,1 & & 0,2 & & \\ Fe & - & 3e & \rightarrow & Fe^{3+}\\ 0,08 & & 0,24 & & \\ Cl_2 & + & 2e & \rightarrow & 2Cl^-\\ a & & 2a & & 2a\\ O_2 & + & 4e & \rightarrow & 2O^{2-}\\ b & & 4b & & 2b\\ Ag^+ & + & e & \rightarrow & Ag\\ x & & x & & x\\ 2H^+ & + & O^{2-} & \rightarrow & H_2O\\ 0,24 & & 0,12 & & \end{matrix}\)
nO = 2b = 0,12 ⇒ b = 0,06
Bảo toàn mol e: 2a + 4b + x = 0,2 + 0,24 = 0,44 ⇒ 2a + x = 0,2
Kết tủa gồm: AgCl (2a + 0,24) mol và Ag x mol
⇒ 143,5(2a + 0,24) + 108x = 61,01
⇒ 287a + 108x = 26,57
⇒ a = 0,07 và x = 0,06
⇒ X gồm 0,07 mol Cl2 và 0,06 mol O2
\(\Rightarrow \%V_{O_2} = 46,15\%\)
4. Luyện tập Bài 31 Hóa học 12
Sau bài học cần nắm:
- Vị trí của Sắt trong Bảng hệ thống tuần hoàn các nguyên tố hóa học
- Cấu tạo nguyên tử, tính chất vật lí - hóa học và phương pháp điều chế.
- Biết được tính chất và ứng dụng của một số hợp chất quan trọng của Sắt.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 31 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. sự khử Fe2+ và sự oxi hoá Cu.
- B. sự khử Fe2+ và sự khử Cu2+.
- C. sự khử Fe2+ và sự khử Cu2+.
- D. sự oxi hoá Fe và sự khử Cu2+.
-
- A. 2.
- B. 3.
- C. 4.
- D. 5.
-
- A. Mg2+.
- B. Zn2+.
- C. Cu2+.
- D. Al3+.
-
- A. Fe(NO3)3.
- B. CuCl2.
- C. Zn(NO3)2.
- D. AgNO3
-
- A. Cr2+, Au3+, Fe3+
- B. Fe3+, Cu2+, Ag+
- C. Zn2+, Cu2+, Ag+
- D. Cr2+, Cu2+, Ag+
-
- A. Fe(NO3)2 , Fe(NO3)3 , AgNO3.
- B. Fe(NO3)2, AgNO3.
- C. Fe(NO3)3, AgNO3.
- D. Fe(NO3)2, Fe(NO3)3.
-
- A. Cu(NO3)2.
- B. Fe(NO3)3.
- C. Fe(NO3)2.
- D. HNO3.
-
- A. Cu(NO3)2, Fe(NO3)2 và Cu, Fe.
- B. Cu(NO3)2, Fe(NO3)2 và Ag, Cu.
- C. Fe(NO3)2, Fe(NO3)3 và Cu, Ag.
- D. Cu(NO3)2, AgNO3 và Cu, Ag
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 31.
Bài tập 31.12 trang 73 SBT Hóa học 12
Bài tập 31.13 trang 73 SBT Hóa học 12
Bài tập 31.14 trang 73 SBT Hóa học 12
Bài tập 31.15 trang 73 SBT Hóa học 12
Bài tập 31.16 trang 74 SBT Hóa học 12
Bài tập 31.17 trang 74 SBT Hóa học 12
Bài tập 31.18 trang 74 SBT Hóa học 12
Bài tập 31.19 trang 74 SBT Hóa học 12
Bài tập 31.20 trang 74 SBT Hóa học 12
Bài tập 31.21 trang 74 SBT Hóa học 12
Bài tập 1 trang 189 SGK Hóa học 12 nâng cao
Bài tập 2 trang 189 SGK Hóa học 12 nâng cao
5. Hỏi đáp về Bài 31 Chương 7 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 12
Lớp 12 - Năm cuối ở cấp tiểu học, năm học quan trọng nhất trong đời học sinh trải qua bao năm học tập, bao nhiêu kì vọng của người thân xung quanh ta. Những nỗi lo về thi đại học và định hướng tương lai thật là nặng. Hãy tin vào bản thân là mình sẽ làm được rồi tương lai mới chờ đợi các em!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK