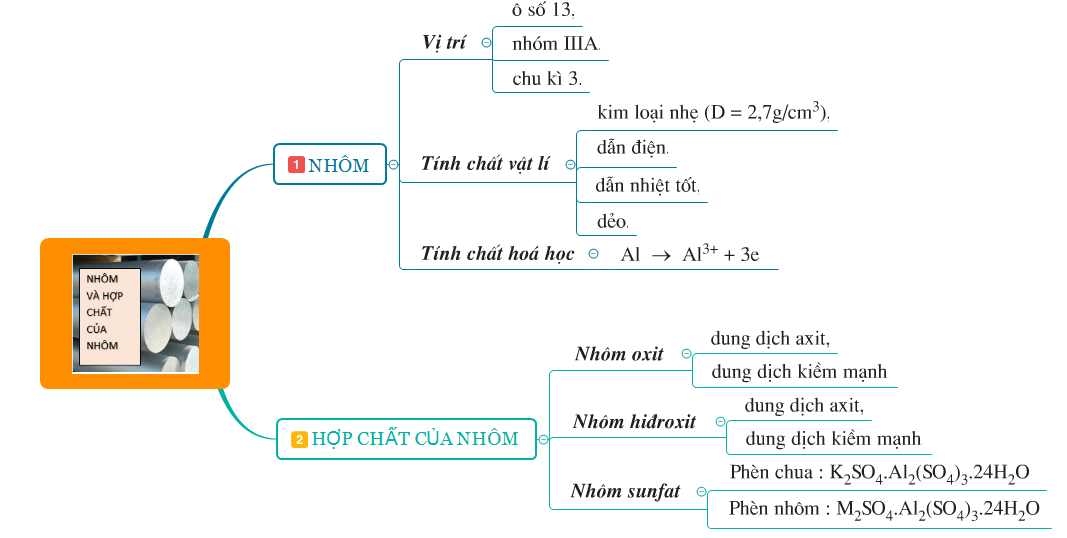
Hoá học 12 Bài 29: Luyện tập Tính chất của nhôm và hợp chất của nhôm
Tóm tắt bài
3.1. Bài tập Tính chất của nhôm và hợp chất của nhôm - Cơ bản
Bài 1:
Có 3 chất rắn là: Mg, Al, Al2O3. Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết các phương trình hóa học.
Hướng dẫn:
Cho 3 chất rắn vào 3 ống nghiệm đựng dung dịch NaOH riêng biệt. Nếu có khí bay lắm lên, đó là Al. Nếu chất rắn tan, đó là Al2O3. Nếu không có hiện tượng gì là Mg
Phương trình hóa học của các phản ứng.
\(\begin{array}{l} 2Al{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ }}6{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} + 3{H_2} \uparrow \\ A{l_2}{{\rm{O}}_3}{\rm{ }} + {\rm{ }}2NaOH{\rm{ }} + {\rm{ 3}}{H_2}O \to 2Na[Al{(OH)_4}{\rm{]}} \end{array}\)
Bài 2:
Cho m gam Al tan hoàn toàn vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
Giá trị của m là:
Hướng dẫn:
Dung dịch Z gồm: \(\, \left\{\begin{matrix} AlCl_{3} : x \ (mol ) \\ HCl: x \ (mol) \ \end{matrix}\right. \Rightarrow 4x = y \ (BTNT \ Cl)\)
Theo sơ đồ khi cho 5,16 mol NaOH vào dung dịch Z thì xảy ra 3 phản ứng và thu được 0,7x mol Al(OH)3
⇒ Số mol NaAlO2 = 0,3x mol
⇒ x + 3.0,7x + 4.0,3x = 5,16 ⇒ x = 1,2 mol ⇒ Số mol Al ban đầu = 1,2 ⇒ m = 32,4 gam
Bài 3:
Cho 100 ml dung dịch hỗn hợp Al2(SO4)3 1M và CuSO4 1M tác dụng với dung dịch NaOH dư. Kết tủa thu được đem nung đến khối lượng không đổi thu được chất rắn có khối lượng là:
Hướng dẫn:
\(n_{Al_2(SO_4)_3} = 0,1\ mol\)
\(n_{CuSO_4} = 0,1\ mol\)
Do tác dụng dd NaOH dư nên Al(OH)3 tan chỉ còn lại Cu(OH)2
\(n_{CuSO_4} = n_{Cu(OH)_2} = 0,1\)
\(\begin{matrix} CuSO_4 & \xrightarrow[]{t^0} & CuO & + & H_2O\\ 0,1 & \rightarrow & 0,1 \end{matrix}\)
mchất rắn = 0,1 × 80 = 8 g
3.2. Bài tập Tính chất của nhôm và hợp chất của nhôm - Nâng cao
Bài 1:
Hoà tan hoàn toàn 47,4 gam phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
n phèn chua = \(\frac{47,4}{474}\) = 0,1 mol
\(n_{KAl(SO_4)_2.12H_2O} = m_{KAl(SO_4)_2} = 0,1\)
\(n_{Ba(OH)_2} = 0,2\ mol\)
\(\begin{matrix} KAl(SO_4)_2 & \rightarrow & K^+ & + & Al^{3+} & + & 2{SO_4}^{2-}\\ 0,1 & \rightarrow & 0,1 & & 0,1 & & 0,2 \end{matrix}\)
\(\begin{matrix} Ba(OH)_2 & \rightarrow & Ba^{2+} & + & 2OH^-\\ 0,2 & \rightarrow & 0,2 & & 0,4 \end{matrix}\)
\(\begin{matrix} Ba^{2+} & + & {SO4}^{2-} & \rightarrow & BaSO_4\downarrow\\ 0,2 & & 0,2 & \rightarrow & 0,2 \end{matrix}\)
\(\begin{matrix} Al^{3+} & + & 3OH^- & \rightarrow & Al(OH)_3\downarrow\\ 0,1 & \rightarrow & 0,3 & & 0,1\\ & & du\ 0,1 \end{matrix}\)
\(\begin{matrix} Al(OH)_3 & + & OH^- & \rightarrow & {AlO2}^- & + & H_2O\\ 0,1 & \gets & 0,1 \end{matrix}\)
Vây kết tủa chỉ còn BaSO4↓
\(m_{BaSO_4} = 0,2 \times 233 = 46,6\ g\)
Bài 2:
Dung dịch A là dung dịch NaOH. Lấy 100 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M thì lượng kết tủa sinh ra bằng với lượng kết tủa khi lấy 500 ml dung dịch A trộn với 400 ml dung dịch AlCl3 0,1M. Giá trị CM dung dịch NaOH là:
Hướng dẫn:
Đặt \(C_{M_{NaOH}} = x M\)
⇒ nNaOH (100ml) = 0,1x mol
nNaOH (500ml) = 0,5x mol
\(n_{AlCl_3} = 0,4 \times 0,1 = 0,04\ mol\)
Lượng kết tủa 2 TN bằng nhau ⇒
- TN1: Kết tủa chưa cực đại, OH- hết.
- TN2: Kết tủa cực đại và tan 1 phần.
\(\begin{matrix} & Al3+ & + & 3OH- & \rightarrow & Al(OH)3 \downarrow\\ I: & & & 0,1x & \rightarrow & \frac{0,1x}{3}\\ II: & 0,04 & \rightarrow & 0,12 & \rightarrow& 0,04 \end{matrix}\)(cực đại)
\(\begin{matrix} & Al(OH)_3 & + & OH^- & \rightarrow & {AlO_2}^- & + & 2H_2O\\ tan & y & \rightarrow & y \end{matrix}\)
⇒ \(\begin{matrix} 0,04 - y = \frac{0,1x}{3}\ (1)\\ 0,12 + y = 0,5x\ (2) \end{matrix}\)
Từ (1), (2) ⇒ x = 0,3; y = 0,3
\(\Rightarrow C_{M_{NaOH}} = 0,3\)
4. Luyện tập Bài 29 Hóa học 12
Sau bài học cần nắm:
- Nhôm và các hợp chất như Al2O3 (Nhôm oxit), Al(OH)3 (Nhôm hidroxit), Al2(SO4)3 (Nhôm sunfat)....
- Kĩ năng giải các bài tập và các dạng toán quan trọng.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 29 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. quặng pirit.
- B. quặng đôlômit.
- C. quặng manhetit.
- D. quặng boxit.
-
- A. Al
- B. Fe
- C. Cr
- D. Cr và Al
-
- A. Al(OH)3, Al(NO3)3
- B. Al(OH)3, Al2O3
- C. Al2(SO4)3, Al2O3
- D. Al2(SO4)3, Al(OH)3
-
- A. Không có phản ứng xảy ra.
- B. Tạo kết tủa Al(OH)3, phần dung dịch chứa Na2CO3.
- C. Tạo kết tủa Al(OH)3, phần dung dịch chứa NaHCO3.
- D. Tạo kết tủa Al(OH)3, sau đó kết tủa bị hòa tan lại.
-
- A. Nhôm không tác dụng với dung dịch H2SO4 loãng, nguội.
- B. Nhôm có tính dẫn điện và dẫn nhiệt lớn hơn tính dẫn điện và dẫn nhiệt của sắt.
- C. Trong công nghiệp, nhôm được sản xuất từ quặng boxit.
- D. Nhôm có cấu tạo kiểu mạng tinh thể lập phương tâm diện.
-
Câu 6:
Có ba chất rắn riêng biệt: Al, Mg, Al2O3. Dung dịch có thể phân biệt được 3 chất rắn trên là:
- A. NaOH.
- B. HCl.
- C. HNO3 loãng.
- D. CuCl2.
-
Câu 7:
Công thức của phèn chua là:
- A. K2SO4.Cr2(SO4)3.24H2O.
- B. K2SO4.Al2(SO4)3.24H2O.
- C. (NH4)2SO4.Al2(SO4)3.24H2O.
- D. Na2SO4.Al2(SO4)3.24H2O.
-
- A. C2H2 và CH4
- B. CH4 và H2.
- C. CH4 và C2H6.
- D. C2H2 và H2.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 29.
Bài tập 29.6 trang 69 SBT Hóa học 12
Bài tập 29.7 trang 69 SBT Hóa học 12
Bài tập 29.8 trang 69 SBT Hóa học 12
Bài tập 29.9 trang 69 SBT Hóa học 12
Bài tập 29.10 trang 69 SBT Hóa học 12
Bài tập 29.11 trang 70 SBT Hóa học 12
Bài tập 29.12 trang 70 SBT Hóa học 12
Bài tập 29.13 trang 70 SBT Hóa học 12
Bài tập 29.14 trang 70 SBT Hóa học 12
Bài tập 1 trang 183 SGK Hóa học 12 nâng cao
Bài tập 4 trang 183 SGK Hóa học 12 nâng cao
Bài tập 6 trang 183 SGK nâng cao Hóa học 12
5. Hỏi đáp về Bài 29 Chương 6 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 12
Lớp 12 - Năm cuối ở cấp tiểu học, năm học quan trọng nhất trong đời học sinh trải qua bao năm học tập, bao nhiêu kì vọng của người thân xung quanh ta. Những nỗi lo về thi đại học và định hướng tương lai thật là nặng. Hãy tin vào bản thân là mình sẽ làm được rồi tương lai mới chờ đợi các em!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)