Hoá học 11 Bài 17: Silic và hợp chất của silic
Tóm tắt bài
1.1. SILIC
1.1.1. Tính chất vật lí
- Silic gồm có : Silic tinh thể và vô định hình
- Silic tinh thể có cấu trúc giống kim cương, màu xám, ánh kim, có tính bán dẫn, nóng chảy ở 14200C
- Silic vô định hình là chất bột màu nâu
- Silic có tính chất vật lí của nguyên tố nửa kim loại.
1.1.2. Tính chất hóa học
- Số oxi hóa của Si giống C: -4, 0, +2, +4
- Vừa có tính khử, vừa có tính oxy hoá.
Tính khử
Tác dụng với phi kim
- Với Flo ở đk thường: Si + 2F2 → SiF4
- Với halogen, O2: ở tO cao
Si + 2Cl2 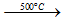
Si + O2 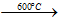
- Với C,N,S: ở to rất cao
Si + C 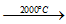
Tác dụng với hợp chất:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Tính oxy hoá
Khi tác dụng với kim loại ở tO cao tạo các silixua kim loại
Si + Mg .PNG)
1.1.3. Trạng thái tự nhiên

Hình 1: Tinh thể thạch anh
- Silic là nguyên tố phổ biến thứ hai sau Oxi, chiếm gần 29,5% khối lượng Vỏ Trái Đất.
- Trong tự nhiên không có Silic tự do, mà chỉ gặp được ở dạng hợp chất: chủ yếu silic đioxit; các khoáng vật silicat; cao lanh, thạch anh, ...
1.1.4. Ứng dụng
Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật
Hình 2: Ứng dụng của Silic
1.1.5. Điều chế
Nguyên tắc:
Dùng chất khử mạnh (Mg, Al, C…) khử SiO2 ở t0 cao
SiO2 + 2Mg .PNG)
1.2. Hợp chất của silic
1.2.1. Silic đioxít (SiO2)
Tính chất vật lý
Silic đioxit là chất ở dạng tinh thể, nóng chảy ở 1713oC, không tan trong nước.
Tính chất hoá học
- Oxít axít nên tác dụng kiềm đặc nóng hoặc nóng chảy.
SiO2 + 2NaOH .PNG)
- SiO2 tan được trong HF.
SiO2 + 4HF → SiF4 + 2H2O
→ Dung dịch HF dùng để khắc chữ và hình trên thuỷ tinh.
1.2.2. Axít silixic (H2SiO3)
- Kết tủa keo: Không tan trong nước.
- Dễ mất nước khi đun nóng: H2SiO3
SiO2 + H2O
- Là axít yếu, yếu hơn cả H2CO3: Phương trình Na2SiO3+CO2+H2O → H2SiO3 \(\downarrow\)+Na2CO3
1.2.3. Muối silicat
- Đa số muối silicat không tan.
- Chỉ có muối silicat của Kim loại kiềm tan trong H2O.
Bài 1:
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí H2S vào dung dịch axit sunfurơ.
(3) Dập tắt đám cháy Mg, Al bằng khí cacbonic
(4) Cho CaOCl2 tác dụng với HCl đặc.
(5)Cho Si vào dung dịch NaOH loãng
(6) Cho khí CO2 sục vào dung dịch thủy tinh lỏng
(7)Cho dung dịch Na2SiO3 tác dụng với dung dịch H2SO4.
(8) Cho Si vào dung dịch Na2SiO3.
(9)Đun nóng HCOOH trong H2SO4 đặc.
(10) Cho SiO2 tác dụng với Na2CO3 nóng chảy.
Số thí nghiệm tạo ra sản phẩm có chất khí là:
Hướng dẫn:
(1) SiF4; (4) Cl2; (5) H2; (9) CO; (10) CO2
3. Luyện tập Bài 17 Hóa học 11
Sau bài học cần nắm:
- Silic là phi kim hoạt động hóa học yếu, ở nhiệt độ cao tác dụng với nhiều chất (oxi, cacbon, dung dịch NaOH, magie)
- Tính chất hóa học của hợp chất SiO2 (tác dụng với kiềm đặc, nóng, với dung dịch HF)
- Hợp chất H2SiO3 (là axit yếu, ít tan trong nước, tan trong kiềm nóng).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 17 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. HCl.
- B. HI.
- C. HF.
- D. HBr.
-
Câu 2:
Phát biểu nào sau đây sai?
- A. Công nghiệp silicat gồm ngành sản xuất thủy tinh, đồ gốm, xi măng từ các hợp chất thiên nhiên của silic và các hóa chất khác.
- B. Clo được dùng để diệt trùng nước trong hệ thống cung cấp nước sạch.
- C. Nung hỗn hợp quặng photphorit, cát và than cốc trong lò điện để sản xuất phân lân nung chảy.
- D. Lưu huỳnh đioxit được dùng làm chất diệt nấm mốc.
-
- A. 6.
- B. 4.
- C. 5.
- D. 3.
-
- A. Đun SiO2 với NaOH nóng chảy.
- B. Cho SiO2 tác dụng với dung dịch NaOH loãng.
- C. Cho Si tác dụng với dung dịch NaCl.
- D. Cho dung dịch K2SiO3 tác dụng với dung dịch NaHCO3.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 17.
Bài tập 6 trang 79 SGK Hóa học 12
Bài tập 17.1 trang 25 SBT Hóa học 11
Bài tập 17.2 trang 25 SBT Hóa học 11
Bài tập 17.3 trang 25 SBT Hóa học 11
Bài tập 17.4 trang 25 SBT Hóa học 11
Bài tập 17.5 trang 25 SBT Hóa học 11
Bài tập 17.6 trang 25 SBT Hóa học 11
Bài tập 1 trang 92 SGK Hóa học 11 nâng cao
Bài tập 2 trang 92 SGK Hóa học 11 nâng cao
Bài tập 3 trang 92 SGK Hóa học 11 nâng cao
Bài tập 4 trang 92 SGK Hóa học 11 nâng cao
Bài tập 5 trang 92 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 17 Chương 3 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

