Hoá học 11 Bài 3: Sự điện li của nước - pH và Chất chỉ thị axit-bazơ
Tóm tắt bài
1.1. Nước là chất điện li rất yếu
1.1.1. Sự điện li của nước
- Nước là chất điện rất yếu.
- Phương trình điện li: H2O \(\rightleftarrows\) H+ + OH-
1.1.2. Tích số ion của nước
- Ở 25OC, hằng số \({K_{{H_2}O}}\) gọi là tích số ion của nước.
\({K_{{H_2}O}}\) = [H+]. [OH -] = 10-14
→ [H+] = [OH -] = 10-7
- Nước là môi trường trung tính, nên môi trường trung tính là môi trường trong đó [H+] = [OH] = 10-7
1.1.2. Ý nghĩa tích số ion của nước
*Trong môi trường axit
Ví dụ: Tính [H+] và [OH -] của dung dịch HCl 10-3 M.
HCl → H+ + Cl-
10-3 M → 10-3 M
=> [H+] = [HCl] = 10-3 M
=>[OH-] = \(\frac{{{{10}^{ - 14}}}}{{{\rm{[}}{{\rm{H}}^ + }{\rm{]}}}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 3}}}}\) = 10-11M
=> [H+] > [OH-] hay [H+] >10-7 M.
*Trong môi trường bazơ
Vd: Tính [H+] và [OH-] của dung dịch NaOH 10-5 M
NaOH → Na+ + OH-
10-5 M → 10-5 M
=> [OH-] = [NaOH] = 10-5 M
=> [H+] =\(\frac{{{{10}^{ - 14}}}}{{{\rm{[}}O{H^ - }{\rm{]}}}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 5}}}}\) = 10-9 M
=>[OH-] > [H+]
* Kết luận
Vậy [H+] là đại lượng đánh giá độ axít, độ bazơ của dung dịch.
Mt trung tính: [H+] = 10-7 M
Mt bazơ : [H+] -7 M
Mt axít: [H+] > 10-7 M
1.2. Khái niệm về pH, chất chỉ thị axit bazơ
1.2.1. Khái niệm pH
- Dung dịch được sử dụng nhiều thường có [H+] trong khoảng 10 -1 à 10-14 M. Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng pH.
- Công thức: [H+] = 10-pH M hay pH= -lg [H+]
-
Nếu [H+] = 10-a M thì pH = a
Ví dụ:
[H+] = 10-3 M => pH=3 môi trường axít
[H+] = 10-11 M => pH = 11: môi trường bazơ
[H+]= 10-7 M => pH = 7 :môi trường trung tính.
1.2.2. Chất chỉ thị Axit - bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch
- Ví dụ: Quỳ tím, phenolphtalein
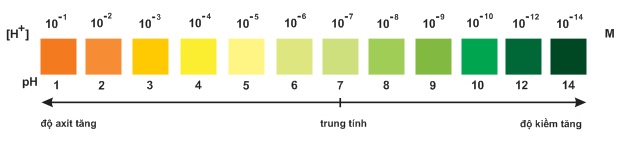
Hình 1: Màu của chất chỉ thị vạn năng
(Thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
Video 1: Chỉ thị đo pH từ bắp cải tím
Bài 1:
Có 5 dung dịch NH3, HCl, NH4Cl, Na2CO3, CH3COOH được đánh ngẫu nhiên là A, B, C, D, E. Gía trị pH và khả năng dẫn điện của dung dịch theo bảng sau:
| Dung dịch | A | B | C | D | E |
| pH | 5,15 | 10,35 | 4,95 | 1,25 | 10,60 |
| Khả năng dẫn điện | Tốt | Tốt | Kém | Tốt | Kém |
Các dung dịch A, B, C, D, E lần lượt là:
Hướng dẫn:
Các chất điện ly mạnh và phân ly ra càng nhiều ion so với số phân tử chất ban đầu thì dẫn điện càng mạnh
Chất dẫn điện tốt: HCl; NH4Cl; Na2CO3
Chất dẫn điện kém là: CH3COOH; NH3
Độ pH tăng dần: HCl; CH3COOH; NH4Cl; NH3; Na2CO3
Bài 2:
Cho các dung dịch có cùng nồng độ mol/l: NaHCO3 (1), Na2CO3 (2), NaCl (3), NaOH (4). pH của các dung dịch tăng theo thứ tự:
Hướng dẫn:
NaOH là bazơ mạnh nên có pH lớn nhất
Muối Na2CO3 có pH > muối NaHCO3 vì HCO3- vẫn còn 1 Hidro có khả năng phân ly thành H+ nhưng vẫn có tính bazo mà không đáng kể
NaCl là muối trung tính nên pH thấp nhất
Vậy ta kết luận pH của các dung dịch tăng theo thứ tự: 3, 1, 2, 4.
Bài 3:
Cho V lít dung dịch Ba(OH)2 0,025M vào 200ml dung dịch X có pH = 1 gồm HNO3 và HCl, thu được dung dịch có pH = 2. Giá trị của V là:
Hướng dẫn:
pH dung dịch sau = 2 + dư
⇒ nH+ - nOH- = nH+ (sau)
⇒ 0,02 – 0,05V = 0,01(V + 0,2)
⇒ V = 0,3 lit
3. Luyện tập Bài 3 Hóa học 11
Sau bài học cần nắm:
- Khái niệm Tích số ion của nước, về pH, chất chỉ thị axit - bazơ
- Đánh giá độ axit và độ kiềm của các dung dịch theo nồng độ ion H+ và pH
- Xác định màu của một số chất chỉ thị trong khoảng pH khác nhau.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 3 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. pH = -lg [H+]
- B. pH + pOH = 14
- C. [H+] = 10a thì pH= a
- D. [H+]. [OH-] = 10-14
-
- A. [ H+ ] .[ OH- ] <1,0.10 -14
- B. [ H+ ] .[ OH- ] =1,0.10 -14
- C. [ H+ ] .[ OH- ]> 1,0.10 -14
- D. [ H+ ] .[ OH-] \(\geq\) 1,0.10 -14
-
- A. NaOH
- B. NaCl
- C. HCl
- D. Na2CO3
-
- A. d < c < a < b.
- B. a < b < c < d.
- C. c < a < d < b.
- D. b < a < c < d.
-
- A. 3.
- B. 2.5.
- C. 1.
- D. 2.
-
- A. 0,23 gam.
- B. 2,3 gam.
- C. 3,45 gam.
- D. 0,46 gam.
-
- A. 7.
- B. 2.
- C. 12.
- D. 3.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao Chương 1 Bài 3
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 3.
Bài tập 6 trang 10 SGK Hóa học 11 nâng cao
Bài tập 7 trang 10 SGK Hóa học 11 nâng cao
Bài tập 1 trang 20 SGK Hóa học 11 nâng cao
Bài tập 2 trang 20 SGK Hóa học 11 nâng cao
Bài tập 3 trang 20 SGK Hóa học 11 nâng cao
Bài tập 4 trang 20 SGK Hóa học 11 nâng cao
Bài tập 5 trang 20 SGK Hóa học 11 nâng cao
Bài tập 6 trang 20 SGK Hóa học 11 nâng cao
Bài tập 7 trang 20 SGK Hóa học 11 nâng cao
Bài tập 8 trang 20 SGK Hóa học 11 nâng cao
Bài tập 9 trang 20 SGK Hóa học 11 nâng cao
Bài tập 10 trang 20 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 3: Sự điện li của nước- pH và Chất chỉ thị axit-bazơ
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK
