Hoá học 10 Bài 12: Liên kết ion - Tinh thể ion
Tóm tắt bài
1.1. SỰ TẠO THÀNH ION, CATION, ANION
1.1.1. Ion, Cation, Anion
Sự tạo thành ion
Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử nhường hay nhận thêm electron thì nó trở thành phần tử mang điện gọi là ion.
Sự tạo thành Cation
- Khi nguyên tử kim loại nhường đi e ngoài cùng thì biến thành ion dương (hay Cation).
- Các nguyên tử kim loại lớp ngoài cùng có 1,2,3 electron → dễ nhường electron để tạo ra cation (ion dương) có cấu hình bền vững của khí hiếm.
Hình 1: Sự hình thành ion Li+
Li → Li+ + 1e
- Cấu hình electron của Li: 1s22s1, Nguyên tử Li dễ nhường 1 electron ở lớp ngoài cùng (1s22s1), trở thành ion dương Li+ (1s2)
- Ví dụ:
Na → Na+ + 1e (cation Natri)
Mg → Mg2+ + 2e (cation Magie)
Al → Al3+ + 3e (cation Nhôm)
- Kết luận:
Trong các phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử kim loại có khuynh hướng nhường e cho nguyên tử nguyên tố khác để trở thành ion dương, gọi là cation.
Tổng quát: M → Mn+ + ne
Sự tạo thành Cation
- Khi nguyên tử phi kim nhận thêm electron thì biến thành ion âm (hay Anion).
- Các nguyên tử phi kim lớp ngoài cùng có 5,6,7e có khả năng nhận thêm electron và biến thành anion (ion âm) có cấu hình bền vững của khí hiếm.
Hình 2: Sự hình thành ion F-
F + 1e → F-
-
Cấu hình e của nguyên tử F : 1s2 2s2 2p5
-
Do có 7e lớp ngoài cùng nên Flo có xu hướng nhận thêm 1e để đạt được cấu hình bền vững của khí hiếm Ne
Hình 3: Sự hình thành ion Cl-
Cl + 1e → Cl-
- Ví dụ: O + 2e → O2-
-
Các anion được gọi theo tên gốc axit (trừ oxi). F- (ion florua), Cl- (ion clorua) ...
- Kết luận:
Trong các phản ứng hóa học, để đạt cấu hình electron bền của khí hiếm nguyên tử phi kim có khuynh hướng nhận e từ nguyên tử các nguyên tố khác để trở thành ion âm, gọi là anion.
Tổng quát: A + ne → An-
1.1.2. Ion đơn nguyên tử Và Ion Đa nguyên tử
Ion đơn nguyên tử
- Là các ion tạo nên từ một nguyên tử.
- Ví dụ: Cation: Na+, Ca2+… Anion: Cl- ,S2- …
Ion đa nguyên tử
- Là những nhóm nguyên tử mang điện tích dương hay âm.
- Ví dụ: Cation: NH4+ ... Anion: SO42-, OH-…
1.2. SỰ TẠO THÀNH LIÊN KẾT ION
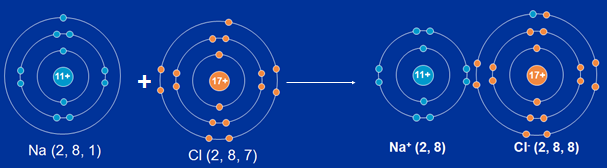
Ví dụ: Xét phân tử NaCl
- Nguyên tử Na nhường 1e cho nguyên tử Cl để biến thành ion dương Na+.
Na → Na+ + 1e
- Mỗi nguyên tử Cl nhận 1e để biến thành ion âm Cl-
Cl + 1e → Cl-
Hình 4: Quá trình hình thành liên kết ion giữa Natri và Clo
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
- Phản ứng hóa học: 2Na + Cl2 → 2 NaCl
1.3. TINH THỂ ION
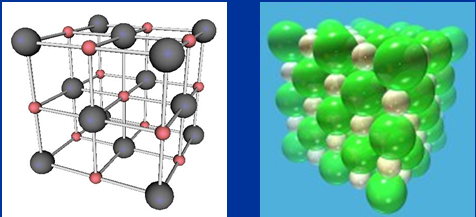
1.3.1. Tinh thể NaCl
-
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể. Trong mạng tinh thể NaCl các ion Na+,Cl- được phân bố luân phiên đều đặn và có trật tự trên các đỉnh của hình lập phương nhỏ. Xung quanh mỗi ion đều có 6 ion ngược dấu liên kết với nó.
Hình 5: Tinh thể ion NaCl
1.3.2. Tính chất chung của hợp chất ion
- Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn. Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
- Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy, khi hòa tan trong nước chúng tạo thành dung dịch dẫn được điện, còn ở trạng thái rắn thì không dẫn được điện.
Bài 1:
Nguyên tố X và Y thuộc nhóm A; nguyên tử nguyên tố X có 7 electron trên các phân lớp s, nguyên tử nguyên tố Y có 17 electron trên các phân lớp p. Công thức hợp chất tạo bởi X và Y; liên kết hóa học trong hợp chất đó là:
Hướng dẫn:
Nguyên tử nguyên tố X có 7 electron trên các phân lớp s
⇒ X: 1s22s23s24s25s1
Vì thuộc nhóm A nên X thuộc nhóm IA
Nguyên tử nguyên tố Y có 17 electron trên các phân lớp p
⇒ Y: 2p63p64p5 ⇒ 4s24p5
Vì Y thuộc nhóm A ⇒ X thuộc nhóm VIIA
⇒ Hợp chất XY: liên kết ion
Bài 2:
Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
Hướng dẫn:
X có e cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II).
Y có e cuối thuộc phân lớp p ⇒ nhóm A (III → VIII).
eX + eY = 20 ⇒ pX + pY = 20
Ta có: X chỉ có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19).
⇒ Ta thấy chỉ có Na (p = 11) ⇒ pY = 9 (Flo) thỏa mãn.
⇒ X - Y: NaF (liên kết ion).
3. Luyện tập Bài 12 Hóa học 10
Sau bài học cần nắm:
- Cấu hình electron của ion đơn nguyên tử cụ thể
- Xác định ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ thể.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Liên kết ion - Tinh thể ion có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. NaCl
- B. HCl
- C. H2O
- D. Cl2
-
- A. 3 ion trên có cấu hình electron giống nhau
- B. 3 ion trên có số nowtron khác nhau
- C. 3 ion trên có số electron bằng nhau
- D. 3 ion trên có số proton bằng nhau
-
- A. 1s2 2s2 2p2
- B. 1s2 2s2 2p4 3s2
- C. 1s2 2s2 2p6
- D. 1s2 2s2 2p5
-
- A. Liên kết kim loại
- B. Liên kết cộng hóa trị có cực
- C. Liên kết cộng hóa trị không cực
- D. Liên kết ion
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Liên kết ion - Tinh thể ion.
Bài tập 12.19 trang 31 SBT Hóa học 10
Bài tập 12.20 trang 31 SBT Hóa học 10
Bài tập 12.21 trang 31 SBT Hóa học 10
Bài tập 12.22 trang 31 SBT Hóa học 10
Bài tập 1 trang 70 SGK Hóa học 10 nâng cao
Bài tập 2 trang 70 SGK Hóa học 10 nâng cao
Bài tập 3 trang 70 SGK Hóa học 10 nâng cao
Bài tập 4 trang 70 SGK Hóa học 10 nâng cao
Bài tập 5 trang 70 SGK Hóa học 10 nâng cao
Bài tập 6 trang 70 SGK Hóa học 10 nâng cao
Bài tập 7 trang 70 SGK Hóa học 10 nâng cao
Bài tập 8 trang 70 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 12 Chương 3 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)
.PNG)