Hoá học 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và Định luật tuần hoàn
Tóm tắt bài
1.1. Tính kim loại, tính phi kim
- Kim loại là những nguyên tố dễ mất electron để trở thành ion dương
- Phi kim là những nguyên tố dễ nhận electron để trở thành ion âm.
-
Kim loại càng mạnh khi khả năng mất electron càng lớn.
-
Phi kim càng mạnh khi khả năng nhận electron càng lớn.
1.1.1. Sự biến đổi tính chất trong một chu kì
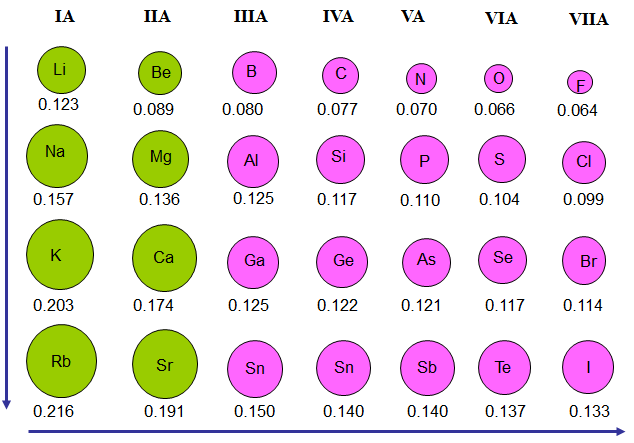
Hình 1: Bán kính nguyên tử của một số nguyên tố
Trong mỗi chu kì, bán kính nguyên tử giảm từ trái qua phải
Trong mỗi nhóm A, bán kính nguyên tử tăng từ trên xuống dưới
- Trong chu kì tính kim loại giảm dần, tính phi kim tăng dần.
-
Theo chiều tăng dần của điện tích hạt nhân thì điện tích hạt nhân tăng dần, số lớp electron không đổi, lực hút giữa hạt nhân và electron lớp ngoài cùng tăng, làm cho bán kính nguyên tử giảm khả năng mất electron giảm, khả năng nhận electron tăng.
1.1.2. Sự biến đổi tính chất trong một nhóm A
-
Tính kim loại tăng dần, tính phi kim giảm dần.
-
Theo chiều tăng dần của điện tích hạt nhân trong nhóm A, số lớp electron tăng dần, làm cho bán kính nguyên tử tăng, lực hút giữa hạt nhân và electron lớp ngoài cùng giảm, khả năng mất electron tăng, khả năng nhận electron giảm.
-
Trong nhóm A theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim giảm dần.
1.1.3. Độ âm điện
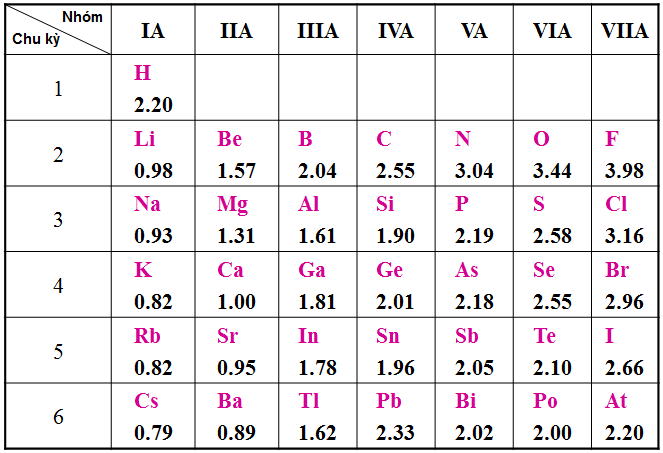
Hình 2: Giá trị Độ âm điện của một số nguyên tố nhóm A trong Bảng tuần hoàn theo Pau-linh
-
Độ âm điện của một nguyên tử càng lớn thì tính phi kim của nó càng mạnh và ngược lại.
-
Trong chu kì theo chiều tăng dần của điện tích hạt nhân giá trị độ âm điện tăng dần.
-
Trong nhóm A theo chiều tăng dần của diện tích hạt nhân, giá trị độ âm điện giảm dần.
-
Sự biến đổi giá trị độ âm điện và tính kim loại, tính phi kim phù hợp với nhau.
-
Độ âm điện của một nguyên tố càng lớn thì tính phi kim càng mạnh, tính kim loại càng giảm và ngược lại.
1.2. Hóa trị của các nguyên tố
-
Trong chu kì 3 đi từ đi từ trái sang phải, hóa trị cao nhất của các nguyên tố đối với oxi tăng từ 1 đến 7 còn hóa trị trong hợp chất khí đối với hiđro giảm từ 4 đến 1
-
Trong chu kì hóa trị cao nhất của các nguyên tố đối với oxi tăng dần và hiđro giảm dần.
| Nhóm | I A | II A | III A | IV A | V A | VI A | VII A |
| Hợp chất với Oxi |
Na2O R2O |
MgO RO |
Al2O3 R2O3 |
SiO2 RO2 |
P2O5 R2O5 |
SO3 RO3 |
Cl2O7 R2O7 |
| Hóa trị cao nhất với Oxi | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Nhóm | I A | II A | III A | IV A | V A | VI A | VII A |
| Hợp chất với Hiidro |
SiH4 RH4 |
PH3 RH3 |
H2S R2S |
HCl HX |
|||
| Hóa trị với Hidro | 4 | 3 | 2 | 1 |
1.3. Oxit và hiđroxit của các nguyên tố nhóm A
Tính bazơ của các oxit và hiđroxit giảm dần đồng thời tính axit của nó mạnh dần.
Na2O + H2O → 2NaOH
Cl2O7 + H2O \(\leftrightarrows\) 2HClO4
1.4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Bài 1:
Viết cấu hình electron của nguyên tử Mg (Z=12). Để đạt cấu hình electron của nguyên tử khí hiếm gần nhất trong bảng tuần hoàn, nguyên tử Mg nhận hay nhường bao nhiêu eletron? Magie thể hiện tính kim loại hay phi kim?
Hướng dẫn:
Cấu hình e của nguyên tử Mg (Z= 12) : 1s22s22p63s2
Mg → Mg2+ + 2e
(2, 8, 2) (2, 8)
3. Luyện tập Bài 9 Hóa học 10
Sau bài học cần nắm:
- Thế nào là tính kim loại, tính phi kim của các nguyên tố hóa học?
- Sự biến đổi tuần hoàn tính kim loại, tính phi kim? Khái niệm độ âm điện và sự biến đổi tuần hoàn độ âm điện.
- Sự biến đổi tuần hoàn hóa trị cao nhất đối với oxi của nguyên tố trong oxit và hóa trị cao nhất trong hợp chất khí đối với hiđro.
- Sự biến đổi tính chất oxit và hiđroxit của các nguyên tố nhóm A. Hiểu được định luật tuần hoàn.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 10 Bài 9 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Tăng theo chiều tăng dần của điện tích hạt nhân.
- B. Giảm theo chiều tăng của điện tích hạt nhân.
- C. Giảm theo chiều tăng của tính phi kim.
- D. B và C đều đúng.
-
- A. Tăng theo chiều tăng của điện tích hạt nhân.
- B. Giảm theo chiều tăng của điện tích hạt nhân.
- C. Giảm theo chiều giảm của tính kim loại.
- D. A và C đều đúng
-
- A. I, Br, Cl, F.
- B. I, Br, F, Cl.
- C. F, Cl, Br, I.
- D. Br, I, Cl, F.
-
- A. F, O, N, C, B, Be, Li.
- B. Li, B, Be, N, C, F, O.
- C. Be, Li, C, B, O, N, F.
- D. N, O, F, Li, Be, B, C.
-
- A. Phi kim mạnh nhất là iot
- B. Phi kim mạnh nhất là liti
- C. Phi kim mạnh nhất là flo
- D. Kim loại yếu nhất là Xesi
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 10 Bài 9.
Bài tập 3 trang 49 SGK Hóa học 10 nâng cao
Bài tập 4 trang 49 SGK Hóa học 10 nâng cao
Bài tập 5 trang 49 SGK Hóa học 10 nâng cao
Bài tập 6 trang 49 SGK Hóa học 10 nâng cao
Bài tập 7 trang 49 SGK Hóa học 10 nâng cao
Bài tập 1 trang 55 SGK Hóa học 10 nâng cao
Bài tập 2 trang 55 SGK Hóa học 10 nâng cao
Bài tập 3 trang 55 SGK Hóa học 10 nâng cao
Bài tập 4 trang 55 SGK Hóa học 10 nâng cao
Bài tập 5 trang 55 SGK Hóa học 10 nâng cao
Bài tập 6 trang 55 SGK Hóa học 10 nâng cao
Bài tập 7 trang 55 SGK Hóa học 10 nâng cao
4. Hỏi đáp về Bài 9 Chương 2 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK