Hoá học 9 Bài 33: Thực hành Tính chất hóa học của phi kim và hợp chất của chúng
Tóm tắt bài
1.1. Kiến thức cần nắm
1.1.1. Thí nghiệm 1: Cacbon khử CuO ở nhiệt độ cao
CO khử CuO theo phương trình: CuO (đen) + CO .PNG)
1.1.2. Thí nghiệm 2: Nhiệt phân muối NaHCO3
Nhiều muối cacbonat (trừ cacbonat trung hoà của kim loại kiềm) dễ bị nhiệt phân huỷ giải phóng khí CO2
2NaHCO3 .PNG)
1.1.3. Thí nghiệm 3: Nhận biết muối cacbonat và muối clorua
- Nhận biết muối cacbonat bằng cách cho phản ứng với axit, với hiện tượng là tạo khí CO2 không màu, mùi hắc
- Lưu ý tính tan trong nước của các muôi. Na2CO3 tan trong nước; còn CaCO3 thì không tan
1.2. Kĩ năng phòng thí nghiệm
- (1) Chỉ được làm thí nghiệm khi có sự hiện diện của giáo viên trong phòng thí nghiệm.
- (2) Đọc kỹ hướng dẫn và suy nghĩ trước khi làm thí nghiệm.
- (3) Luôn luôn nhận biết nơi để các trang thiết bị an toàn.
- (4) Phải mặc áo choàng của phòng thí nghiệm.
- (5) Phải mang kính bảo hộ.
- (6) Phải cột tóc gọn lại.
- (7) Làm sạch bàn thí nghiệm trước khi bắt đầu một thí nghiệm.
- (8) Không bao giờ được nếm các hóa chất thí nghiệm. Không ăn hoặc uống trong phòng thí nghiệm.
- (9) Không được nhìn xuống ống thí nghiệm.
- (10) Nếu làm đổ hóa chất hoặc xảy ra tại nạn, báo cho giáo viên ngay lập tức.
- (11) Rửa sạch da khi tiếp xúc với hóa chất.
- (12) Nếu hóa chất rơi vào mắt, phải đi rửa mắt ngay lập tức.
- (13) Bỏ chất thải thí nghiệm vào đúng nơi qui định như được hướng dẫn.
2.1. Thí nghiệm 1: Cacbon khử CuO ở nhiệt độ cao
- Các em chú ý quan sát các thao tác tiến hành thí nghiệm cũng như hiện tượng của phản ứng:
Video 1: Phản ứng giữa CO và CuO
- Hiện tượng: Hỗn hợp chất rắn trong ống nghiệm chuyển từ màu đen sang màu đỏ, khí sục vào làm cho dd Ca(OH)2 vẫn đục trắng
- Giải thích: Vì đã có các phản ứng
C + 2CuO .PNG)
CO2 + Ca(OH)2 → CaCO3 + H2O
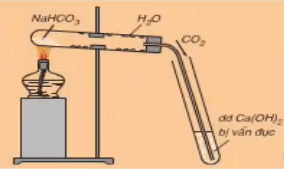
2.2. Thí nghiệm 2: Nhiệt phân muối NaHCO3
- Các em chú ý quan sát các thao tác tiến hành thí nghiệm cũng như hiện tượng của phản ứng:
Hình 1: Nhiệt phân muối NaHCO3
- Hiện tượng: Bọt khí được tạo thành đi qua ống dẫn sục vào dd Ca(OH)2 làm cho dung dịch vẩn đục
- Giải thích: Do xảy ra các phản ứng sau
2NaHCO3 .PNG)
CO2 + Ca(OH)2 → CaCO3 + H2O
2.3. Thí nghiệm 3: Nhận biết muối cacbonat và muối clorua
- Nhận biết 3 lọ đựng 3 chất rắn ở dạng bột là NaCl, Na2CO3 và CaCO3
- Các bước tiến hành:
- Bước 1: Lấy 1 thìa nhỏ mỗi chất cho vào các ống nghiệm
- Bước 2: Dùng ống nhỏ giọt nhỏ vào mỗi lọ chừng 1-2ml dd HCl. Nếu ống nghiệm nào vẫn trong suốt, không có bọt khí bay lên, ống nghiệm đó đựng NaCl, 2 ống nghiệm có bọt khí bay lên đựng Na2CO3 và CaCO3
- Bước 3: Lấy 2 mẫu còn lại (Na2CO3 và CaCO3), dùng ống nhỏ giọt cho vào mỗi ống nghiệm 2-3ml nước cất, lắc nhẹ hoá chất trong ống nghiệm nào không tan thì lọ đó đựng CaCO3, lọ kia đựng Na2CO3
- Các phương trình hóa học đã xảy ra là:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
CaCO3 + 2HCl → CaCl2 + H2O + CO2
3. Tổng kết Bài 33 Hóa học 9
Sau bài học cần nắm:
- Cacbon khử CuO ở nhiệt độ cao
- Nhiệt phân muối NaHCO3
- Nhận biết muối cacbonat và muối clorua
4. Hỏi đáp về Bài 33 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK