Hoá học 9 Bài 31 Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Tóm tắt bài
2.1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Các nguyên tố trong Bảng hệ thống tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
2.2. Cấu tạo bảng tuần hoàn
2.2.1. Ô nguyên tố
Hình 1: Ô nguyên tố
- Ô nguyên tố cho biết: số hiệu nguyên tử, Kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử, số hiệu nguyên tử trùng với số thứ tự của nguyên tố trong bảng tuần hoàn.
2.2.2. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng được xếp theo chiều điện tích hạt nhân tăng dần.
- Gồm 7 chu kì, chu kì 1,2,3 được gọi là chu kì nhỏ, chu kì 4,5,6,7 được gọi là chu kì lớn
| Chu kì | Số nguyên tố thuộc chu kì | Thứ tự nguyên tố | Số lớp electron | Điện tích hạt nhân |
| 1 | 2 | H đến He | 1 | Tăng từ H (1+) đến He (2+) |
| 2 | 8 | Li đến Ne | 2 | Tăng từ Li (3+) đến Ne (10+) |
| 3 | 8 | Na đến Ar | 3 | Tăng từ Na (11+) đến Ar (18+) |
2.2.3. Nhóm
Nhóm gồm các nguyên tố mà nguyên tử của chúng có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử
2.3. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
2.3.1. Trong một chu kì
- Theo chiều tăng dần của điện tích hạt nhân.
- Tính kim loại của các nguyên tố giảm dần , đồng thời tính phi kim tăng dần.
- Ví dụ:
Hình 2: Chu kì 2 trong Bảng hệ thống tuần hoàn
Số electron lớp ngoài cùng tăng từ 1 - 8
Đầu dãy là kim loại mạnh (Li), cuối chu kì là phi kim mạnh (F), kết thúc là khí hiếm (Ne)
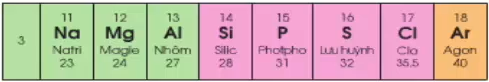
Hình 3: Chu kì 3 trong Bảng hệ thống tuần hoàn
Số electron lớp ngoài cùng tăng từ 11 - 18
Đầu dãy là kim loại mạnh (Na), cuối chu kì là phi kim mạnh (Cl), kết thúc là khí hiếm (Ar)
2.3.2. Trong một nhóm
Trong một nhóm: đi từ trên xuống theo chiều tăng điện tích hạt nhân. Tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim các nguyên tố giảm dần.
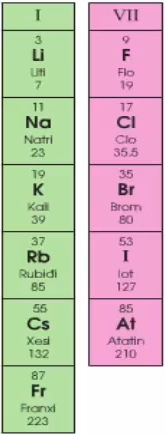
Hình 3: Nhóm I và VII trong Bảng hệ thống tuần hoàn
| Nhóm | Số nguyên tố | Thứ tự nguyên tố | Số lớp electron | Số electron lớp ngoài cùng | Tính chất |
| Nhóm I A | 6 | Li → Fr | 2 - 7 | 1 | Từ Li → Fr tính kim loại tăng dần |
| Nhóm VII A | 5 | F → At | 2 - 6 | 7 | Từ F → At tính phi kim giảm dần |
2.4. Ý nghĩa của bảng tuần hoàn các nguyên tố hoá học
Hình 4: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 1:
Cho nguyên tử A có số hiệu nguyên tử bằng 17, chu kì 3, nhóm VII
Hãy cho biết cấu tạo nguyên tử, tính chất của nguyên tố A và so sánh với các nguyên tố lân cận.
Hướng dẫn:
- Số hiệu nguyên tử là 17 ⇒ Điện tích hạt nhân (17+) và có 17 electron
- Chu kì 3, nhóm VII ⇒ có 3 lớp electron và 7 electron lớp ngoài cùng
- Nguyên tử A ở cuối chi kì 3 nên là Phi kim hoạt động mạnh
| ... | Nhóm VI | Nhóm VII |
| Chu kì 2 | F | |
| Chu kì 3 | S | Cl |
| Chu kì 4 | Br |
- Từ vị trí của các nguyên tử ta nhận xét được như sau:
- Trong một chu kì: Tính phi kim tăng. Như vậy tính phi kim của Cl > tính phi kim của S
- Trong một nhóm: Tính phi kim giảm. Như vậy so về tính phi kim thì F > Cl > Br
Bài 2:
Nguyên tử của nguyên tố X có điện tích hạt nhân là 16+, 3 lớp electron, lớp electron ngoài cùng có 6 electron. Hãy cho biết vị trí của X trong bảng tuần hoàn
Hướng dẫn:
Nguyên tử của nguyên tố X có điện tích hạt nhân là 16+, 3 lớp electron, lớp electron ngoài cùng có 6 electron nên X ở ô 16, chu kì 3, nhóm VI, là một phi kim vì đứng gần cuối chu kì 3 và gần đầu nhóm VI.
4. Luyện tập Bài 31 Hóa học 9
Sau bài học cần nắm:
- Ô nguyên tố, về chu kì và nhóm.
- Từ cấu tạo nguyên tử của một số nguyên tố điển hình (thuộc 20 nguyên tố đầu tiên) dự đoán vị trí và tính chất hoá học cơ bản của chúng và ngược lại.
- So sánh tính kim loại hoặc tính phi kim của một số nguyên tố cụ thể với các nguyên tố lân cận (trong số 20 nguyên tố đầu tiên).
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 31 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Chiều nguyên tử khối tăng dần.
- B. Chiều điện tích hạt nhân tăng dần
- C. Tính kim loại tăng dần.
- D. Tính phi kim tăng dần.
-
- A. Số thứ tự của nguyên tố.
- B. Số electron lớp ngoài cùng.
- C. Số hiệu nguyên tử.
- D. Số lớp electron.
-
- A. Số electron lớp ngoài cùng.
- B. Số thứ tự của nguyên tố.
- C. Số hiệu nguyên tử
- D. Số lớp electron.
-
- A. Be , Fe , Ca , Cu
- B. Ca , K , Mg , Ag
- C. Al , Zn , Co , Ca
- D. Ni , Mg , Li , Fr
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 31.
Bài tập 3 trang 101 SGK Hóa học 9
Bài tập 4 trang 101 SGK Hóa học 9
Bài tập 5 trang 101 SGK Hóa học 9
Bài tập 6 trang 101 SGK Hóa học 9
Bài tập 7 trang 101 SGK Hóa học 9
Bài tập 31.1 trang 39 SBT Hóa học 9
Bài tập 31.2 trang 39 SBT Hóa học 9
Bài tập 31.3 trang 39 SBT Hóa học 9
Bài tập 31.4 trang 39 SBT Hóa học 9
Bài tập 31.5 trang 39 SBT Hóa học 9
Bài tập 31.6 trang 40 SBT Hóa học 9
Bài tập 31.7 trang 40 SBT Hóa học 9
5. Hỏi đáp về Bài 31 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 9
Lớp 9 - Là năm cuối ở cấp trung học cơ sở, sắp phải bước vào một kì thi căng thẳng và sắp chia tay bạn bè, thầy cô và cả kì vọng của phụ huynh ngày càng lớn mang tên "Lên cấp 3". Thật là áp lực nhưng các em hãy cứ tự tin vào bản thân là sẻ vượt qua nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)
.PNG)
.PNG)
.PNG)