Độ tan hay độ hòa tan là đại lượng đặc trưng cho khả năng hòa tan của một chất (rắn, lỏng hay khí) vào dung môi để tạo thành một dung dịch đồng nhất. Vậy công thức tính độ tan như thế nào? Mời các bạn cùng Download.vn theo dõi bài viết dưới đây nhé.
Trong bài học hôm nay chúng tôi sẽ giới thiệu đến các bạn khái niệm, công thức tính và ví dụ minh họa kèm theo một số dạng bài tập về độ tan có đáp án kèm theo. Thông qua tài liệu này các bạn có thêm nhiều tư liệu học tập, nhanh chóng nắm được kiến thức để giải bài tập Hóa học. Ngoài ra các bạn xem thêm công thức hóa học lớp 8.
Công thức tính độ tan
I. Độ tan là gì?
Độ tan (độ hòa tan) của một chất được hiểu là số gam chất đó tan trong 100g dung môi (thường là nước) để tạo thành một dung dịch bão hòa ở một điều kiện nhiệt độ cho trước.
Độ tan của một chất trong nước
Độ tan của một chất trong nước là số gam chất đó hòa tan trong 100g nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định.
II. Công thức tính độ tan
Ví dụ: Ở 25oC khi hòa tan 36 gam muối NaCl vào 100 gam nước thì người ta thu được dung dịch muối bão hòa. Người ta nói độ tan của NaCl ở 25oC là 36 gam hay SNaCl = 36 gam
* Phương pháp giải bài tập tính độ tan:
Áp dụng công thức tính độ tan:
![]()
Trong đó:
mct là khối lượng chất tan để tạo thành dung dịch bão hòa
mdm là khối lượng dung môi (nước) để tạo thành dung dịch bão hòa
III. Những yếu tố ảnh hưởng đến độ tan
Độ tan của chất rắn phụ thuộc vào nhiệt độ. Phần lớn tăng nhiệt độ thì độ tan của chất rắn tăng.
Độ tan của chất khí phụ thuộc vào nhiệt độ và áp suất. Độ tan của chất khí tăng khi giảm nhiệt độ và tăng áp suất.
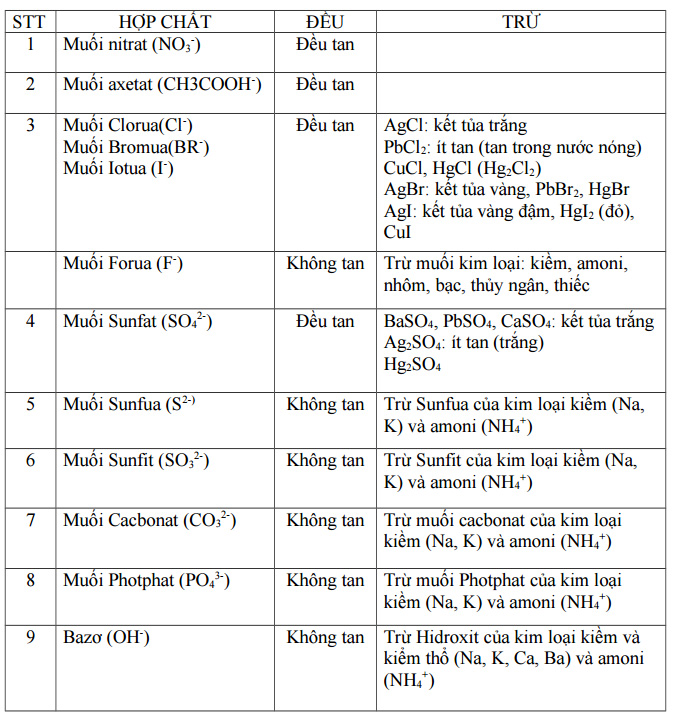
IV. Bảng tính tan của muối và hidroxit
V. Ví dụ minh họa
Ví dụ 1: Tính độ tan của MgSO4 ở 20oC biết rắng ở nhiệt độ này 360 ml nước có thể hòa tan tối đa 129,6 gam MgSO4 tạo thành dung dịch bão hòa
Gợi ý đáp án
Ta có: S = mct/mH2O .100 = 129,6/360 .100 = 36 (g/100g nước)
Ví dụ 2. Ở 25oC, độ tan của NaCl là 36 gam. Thể tích nước cần dùng để hòa tan 1 mol NaCl ở cùng nhiệt độ trên là bao nhiêu?
Gợi ý đáp án
Theo đề bài ta có mNaCl= n.M = 58,5 gam
Ta có: mH2O = mct/S.100 = 58,5/36.100 = 162,5 gam
=> VH2O = 162,5 ml
Ví dụ 3. Xác định độ tan của Na2CO3 trong nước ở 18oC, biết ở nhiệt độ này, hoà tan hết 143 g Na2CO3.10H2O trong 250g nước thì được dung dịch bão hoà
Gợi ý đáp án
nNa2CO3.10H2O = 143/286 = 0,5mol
=> mNa2CO3 = 0,5.106 =53 gam
=> mH2O = 0,5.180=90 gam
Tổng khối lượng nước : 90 + 250 = 340 gam
S = 53/340.100 = 15,59
Vậy độ tan của Na2CO3 ở 18oC là 15,59 gam
VI. Bài tập về độ tan
Bài 1. Có 540 g ddbh AgNO3 ở 100C, đun nóng dd đến 600C thì phải thêm bao nhiêu gam AgNO3 để đạt bảo hòa. Biết độ tan AgNO3 ở 100C và 600C lần lượt là 170g và 525gam.
Bài 2. Xác định lượng kết tinh MgSO4.6H2O khi làm lạnh 1642g ddbh từ 800C xuống 200C. Biết độ tan của MgSO4 là 64,2 g ( 800C) và 44,5g (200C).
Bài 3. Cho biết nồng độ dd bão hòa KAl(SO4)2 ở 200C là 5,56%
a) Tính độ tan của KAl(SO4)2ở 200C
b) Lấy m gam dung dịch bão hòa KAl(SO4)2.12H2O ở 200C để đun nóng bay hơi 200g nước, phần còn lại làm lạnh đến 200C . Tính khối lượng tinh thể phèn KAl(SO4)2.12H2O kết tinh.
8) Cho biết độ tan của CaSO4 là 0,2 gam/100g nước ở nhiệt độ 200C và khối lượng riêng của dung dịch bão hòa CaSO4 ở 200C là D =1g/ml. Nếu trộn 50ml dung dịch CaCl2 0,012M với 150ml dung dịch Na2SO4 0,04M ( ở 200C) thì có kết tủa xuất hiện hay không ?
Hướng dẫn : tính nồng độ của CaSO4 trong dung dịch thu được, nếu bé hơn nồng độ bão hòa thì không có kết tủa ( và ngược lại) . Kết quả : không có kết tủa.
Bài 4) Ở 120C có 1335gam dung dịch bão hòa CuSO4 . Đun nóng dung dịch lên đến 900C. Hỏi phải thêm vào dung dịch bao nhiêu gam CuSO4 nữa để được dung dịch bão hòa ở nhiệt độ này.
Biết độ tan CuSO4 ở 120C và 900C lần lượt là 33,5g và 80g
(ĐS: 465gam CuSO4 )
Bài 5) Thêm dẫn dung dịch KOH 33,6% vào 40,3ml dung dịch HNO3 37,8% ( D = 1,24 g/ml) đến khi trung hòa hòan toàn thì thu được dung dịch A. Đưa dung dịch A về 00C thì được dung dịch B có nồng độ 11,6% và khối lượng muối tách ra là m (gam). Hãy tính m và cho biết dung dịch B đã bão hòa chưa ? vì sao ?
ĐS: m = 21,15 gam , dung dịch đã bão hòa vì có m ( gam ) muối không tan thêm được nữa
