Cho hỗn hợp (Y) gồm 2,8 gam Fe và 0,81 gam Al vào 200ml dung dịch (C) chứa AgNO3 và Cu(NO3)2. Kết thúc phản ứng thu được dung dịch (D) và 8,12 gam chất rắn (E) gồm ba kim loại. Cho...
Câu hỏi :
Cho hỗn hợp (Y) gồm 2,8 gam Fe và 0,81 gam Al vào 200ml dung dịch (C) chứa AgNO3 và Cu(NO3)2. Kết thúc phản ứng thu được dung dịch (D) và 8,12 gam chất rắn (E) gồm ba kim loại. Cho (E) tác dụng với dung dịch HCl dư, ta thu được 0,672 lít H2 (đktc). Tính nồng độ mol/l AgNO3, Cu(NO3)2 trước khi phản ứng.
Cho hỗn hợp (Y) gồm 2,8 gam Fe và 0,81 gam Al vào 200ml dung dịch (C) chứa AgNO3 và Cu(NO3)2. Kết thúc phản ứng thu được dung dịch (D) và 8,12 gam chất rắn (E) gồm ba kim loại. Cho (E) tác dụng với dung dịch HCl dư, ta thu được 0,672 lít H2 (đktc). Tính nồng độ mol/l AgNO3, Cu(NO3)2 trước khi phản ứng.
B. CM AgNO3 = 0,16M; CM Cu(NO3)2 = 0,25M.
D. CM AgNO3 = 0,26M; CM Cu(NO3)2 = 0,15M.
* Đáp án
A
* Hướng dẫn giải
Vì phản ứng giữa Al và AgNO3 xảy ra trước nên kim loại sau phản ứng phải có Ag, kế đến là CuSO4 có phản ứng tạo thành Cu. Theo giả thiết, có ba kim loại → kim loại thứ ba là Fe còn dư.
Ta có: nFe = 2,8/5,6 = 0,05 (mol)
nAl = 0,81/27 = 0,03 (mol)
và nH2 = 0,672/22,4 = 0,03 (mol)
Phản ứng: Fedư (0,03) + 2HCl → FeCl2 + H2 (0,03)
→ Số mol Fe phản ứng với muối: 0,05 – 0,03 = 0,02 (mol)
2Al + 3Cu2+ → 2Al3+ + 3Cu
Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Ta có sự trao đổi electron như sau:
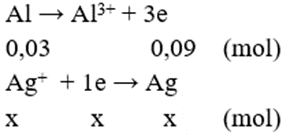
→ x + 2y = 0,09 + 0,04 = 0,13 (1); 108x + 64y + 56.0,03 = 8,12 (2)
Giải hệ phương trình (1) và (2), ta được x = 0,03; y = 0,05.
Vậy: CM AgNO3 = 0,03 : 0,2 = 0,15M
CM Cu(NO3)2 = 0,05 : 0,2 = 0,25M.
→ Đáp án A
Câu hỏi trên thuộc đề trắc nghiệm dưới đây !
Trắc nghiệm chuyên đề Hóa 12 Chủ đề 7: Ôn tập và kiếm tra chuyên đề đại cương về kim loại có đáp án !!
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 12
Lớp 12 - Năm cuối ở cấp tiểu học, năm học quan trọng nhất trong đời học sinh trải qua bao năm học tập, bao nhiêu kì vọng của người thân xung quanh ta. Những nỗi lo về thi đại học và định hướng tương lai thật là nặng. Hãy tin vào bản thân là mình sẽ làm được rồi tương lai mới chờ đợi các em!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK
