Đề thi Học kì 2 Hóa học 10 cực hay có đáp án !!
Câu hỏi 1 :
Khi lần lượt tác dụng với mỗi chất dưới đây, trường hợp axit sunfuric đặc và axit sunfuric loãng hình thành sản phẩm giống nhau là
A.
B. Mg
C.
D.
Câu hỏi 2 :
Kim loại nào cho nhiều thể tích khí hơn khi cho cùng một khối lượng hai kim loại Zn và Fe tác dụng hết với axit ?
A. không xác định được
B. Zn
C. bằng nhau
D. Fe
Câu hỏi 3 :
Trong các cặp chất sau, cặp chất gồm hai chất phản ứng được với nhau là
A. NaCl và
B. và HCl
C. và HCl
D. và
Câu hỏi 4 :
Cho 1,53 gam hỗn hợp Ba, Mg, Fe và Zn vào dung dịch HCl dư thấy thoát ra 448 ml khí (đktc). Cô cạn hỗn hợp sau phản ứng thì thu được chất rắn có khối lượng là
A. 2,24 gam
B. 2,95 gam
C. 1,85 gam
D. 3,90 gam
Câu hỏi 5 :
Tính chất hóa học của đơn chất lưu huỳnh là
A. chỉ thể hiện tính khử
B. không thể hiện tính chất nào
C. chỉ thể hiện tính oxi hóa
D. tính khử và tính oxi hóa
Câu hỏi 6 :
Nung 43,8 gam hỗn hợp hai muối cacbonat của hai kim loại thuộc hai chu kì liên tiếp của nóm IIA, thu được 11,2 lít khí (đktc). Hai kim loại đó là
A. Mg và Ca
B. Sr và Ba
C. Ca và Sr
D. Be và Mg
Câu hỏi 10 :
Cho phản ứng hóa học:
A. Lưu huỳnh trong bị khử, S trong bị oxi hóa
B. Lưu huỳnh bị khử và không có chất nào bị oxi hóa
C. Lưu huỳnh bị oxi hóa và hiđro bị khử
D. Lưu huỳnh bị khử và hiđro bị oxi hóa
Câu hỏi 11 :
Cho 9,12 gam hỗn hợp gồm tác dụng với dung dịch HCl (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn Y thu được 7,62 gam và m gam . Giá trị của m là
A. 7,80
B. 8,75
C. 6,50
D. 9,75
Câu hỏi 13 :
Cho dung dịch chứa 1 gam HCl vào dung dịch chứa 1 gam NaOH. Nhúng giấy quỳ tím vào dung dịch sau phản ứng thì giấy quỳ tím chuyển sang màu gì?
A. màu xanh
B. không xác định được
C. màu đỏ
D. không đổi màu
Câu hỏi 14 :
Bạc tiếp xúc với không khí có bị biến đổi thành bạc sunfua:
A. là chất oxi hóa, Ag là chất khử
B. Ag là chất khử, là chất oxi hóa
C. là chất khử, Ag là chất oxi hóa
D. Ag là chất oxi hóa, là chất khử
Câu hỏi 16 :
Đốt cháy hoàn toàn 7,2 gam một kim loại có hóa trị II cần dùng hết 3,36 lít oxi (đktc). Kim loại đó là
A. Zn
B. Cu
C. Fe
D. Mg
Câu hỏi 17 :
Trong các chất cho dưới đây, chất được dùng làm thuốc thử để nhận biết ion clorua trong dung dịch là
A.
B.
C.
D.
Câu hỏi 19 :
Sục 2,24 lít khí (đktc) vào 500 ml dung dịch NaOH 0,3M. Muối thu được sau phản ứng là
A.
B.
C.
D.
Câu hỏi 20 :
Hòa tan hoàn toàn hỗn hợp kim loại gồm Mg, Cu và Fe trong dung dịch axit HCl, thu được dung dịch X, chất rắn Y và khí Z. Cho X tác dụng hoàn toàn với dung dịch NaOH, thu được kết tủa T. Nung hoàn toàn T trong không khí thu được chất rắn gồm
A. và CuO
B. MgO và Cu
C. MgO và
D. MgO và FeO
Câu hỏi 23 :
Hòa tan m gam Fe trong dung dịch loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam sắt này vào dung dịch đặc, nóng thì thể tích khí (đktc) sinh ra bằng
A. 2,24 lít
B. 5,04 lít
C. 3,36 lít
D. 10,08 lít
Câu hỏi 24 :
Thổi vào 500 ml dung dịch đến khi vừa mất màu hoàn toàn, thu được dung dịch X. Để trung hòa X cần 250 ml dung dịch NaOH 0,2M. Nồng độ dung dịch ban đầu là
A. 0,02M
B. 0,005M
C. 0, 01M
D. 0,025M
Câu hỏi 25 :
Cho cân bằng hóa học:
A. giảm nhiệt độ của phản ứng
B. giảm nồng độ của , thêm xúc tác
C. tăng nhiệt độ của phản ứng
D. giữ phản ứng ở nhiệt độ thường
Câu hỏi 26 :
Hòa tan hoàn toàn m gam hỗn hợp gồm trong dung dịch axit 40% (vừa đủ) thu được 8,96 lít hỗn hợp khí có tỉ khối đối với bằng 16,75 và dung dịch Y có nồng độ 51,449%. Cô cạn Y thu được 170,4 gam muối. Giá trị của m là
A. 23,8
B. 50,4
C. 37,2
D. 50,6
Câu hỏi 27 :
Cho 1,9 gam hỗn hợp muối cacbonat và hiđrocacbonat của kim loại kiềm M tác dụng hết với dung dịch HCl dư, sinh ra 0,448 lít khí (đktc). Kim loại M là
A. Li
B. K
C. Rb
D. Na
Câu hỏi 28 :
Hòa tan vừa hết 23,3 gam hỗn hợp bột gồm và bằng 500 ml dung dịch hỗn hợp gồm HCl 2M và 0,5M. Sau phản ứng thu được dung dịch X và 5,6 lít khí (đktc). Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 78,5
B. 74,8
C. 74,3
D. 75,3
Câu hỏi 29 :
Chia 156,8 gam hỗn hợp L gồm thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hết với dung dịch HCl dư được 155,4 gam muối khan. Phần thứ hai tác dụng vừa đủ với dung dịch M chứa loãng thu được 167,9 gam muối khan. Số mol của HCl trong dung dịch M là
A. 1,75 mol
B. 1,5 mol
C. 1,8 mol
D. 1,0 mol
Câu hỏi 30 :
Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm và thì thu được 1,008 lít khí (đktc) và dung dịch B. Cho dung dịch B tác dụng với dung dịch dư thì thu được 29,55 gam kết tủa. Nồng độ mol của và trong dung dịch A lần lượt là
A. 0,20M và 0,40M
B. 0,21M và 0,32M
C. 0,18M và 0,26M
D. 0,21M và 0,18M
Câu hỏi 32 :
A.NaOH, CuO, Mg.
A.NaOH, CuO, Mg.
B.Fe(OH)2, Na2O, Cu.
C.Fe, KOH, KCl.
D.BaO, Ag, Fe2O3.
Câu hỏi 39 :
A.Không bị chuyển dịch.
A.Không bị chuyển dịch.
B.Chuyển dịch từ phải sang trái.
C.Chuyển dịch từ trái sang phải.
D.Sẽ dừng lại.
Câu hỏi 44 :
A.Không bị chuyển dịch.
A.Không bị chuyển dịch.
B.Sẽ dừng lại.
C.Chuyển dịch từ trái sang phải.
D.Chuyển dịch từ phải sang trái.
Câu hỏi 49 :
A.Cl2 >Br2 >I2 >F2.
A.Cl2 >Br2 >I2 >F2.
B.F2 >Cl2 >Br2 >I2.
C.I2 >Br2 >Cl2 >F2.
D.Br2 >F2 >Cl2 >I2.
Câu hỏi 53 :
Để nhận biết các dung dịch mất nhãn HCl, HI, Na2SO4dùng thuốc thử nào sau đây:
A.AgNO3.
B.AgNO3, BaCl2.
C.Quỳ tím, Ba(OH)2.
Câu hỏi 54 :
A.Không bị chuyển dịch.
A.Không bị chuyển dịch.
B.Sẽ dừng lại.
C.Chuyển dịch từ trái sang phải.
D.Chuyển dịch từ phải sang trái.
Câu hỏi 59 :
A.Cl2 >Br2 >I2 >F2.
A.Cl2 >Br2 >I2 >F2.
B.F2 >Cl2 >Br2 >I2.
C.I2 >Br2 >Cl2 >F2.
D.Br2 >F2 >Cl2 >I2.
Câu hỏi 71 :
A.HF >HCl >HBr >HI.
A.HF >HCl >HBr >HI.
B.HBr >HF >HCl >HI.
C.HI >HBr >HCl >HF.
D.HCl >HBr >HI >HF.
Câu hỏi 74 :
A.Sẽ dừng lại.
A.Sẽ dừng lại.
B.Không bị chuyển dịch.
C.Chuyển dịch theo chiều thuận.
D.Chuyển dịch theo chiều nghịch.
Câu hỏi 78 :
A.HF >HCl >HBr >HI.
A.HF >HCl >HBr >HI.
B.HBr >HF >HCl >HI.
C.HCl >HBr >HI >HF.
D.HI >HBr >HCl >HF.
Câu hỏi 85 :
A.Sẽ dừng lại.
A.Sẽ dừng lại.
B.Không bị chuyển dịch.
C.Chuyển dịch theo chiều nghịch.
D.Chuyển dịch theo chiều thuận.
Câu hỏi 87 :
A.HF >HCl >HBr >HI.
A.HF >HCl >HBr >HI.
B.HBr >HF >HCl >HI.
C.HCl >HBr >HI >HF.
D.HI >HBr >HCl >HF.
Câu hỏi 96 :
A.Sẽ dừng lại.
A.Sẽ dừng lại.
B.Không bị chuyển dịch.
C.Chuyển dịch theo chiều nghịch.
D.Chuyển dịch theo chiều thuận.
Câu hỏi 104 :
A.HF >HCl >HBr >HI.
A.HF >HCl >HBr >HI.
B.HBr >HF >HCl >HI.
C.HI >HBr >HCl >HF.
D.HCl >HBr >HI >HF.
Câu hỏi 105 :
A.Sẽ dừng lại.
A.Sẽ dừng lại.
B.Không bị chuyển dịch.
C.Chuyển dịch theo chiều thuận.
D.Chuyển dịch theo chiều nghịch.
Câu hỏi 113 :
A. Cho khí Cl2vào dung dịch NaCl.
A. Cho khí Cl2vào dung dịch NaCl.
B. Sục khí Cl2vào dung dịch KOH.
C. Điện phân dung dịch NaCl không có màng ngăn.
D. Cho khí Cl2đi từ từ qua dung dịch NaOH, NaCl.
Câu hỏi 117 :
A. không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
A. không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
B. tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
C. tác động của các yếu tố từ bên trong tác động lên cân bằng.
D. cân bằng hóa học tác động lên các yếu tố bên ngoài.
Câu hỏi 121 :
A. cháy trong không khí.
A. cháy trong không khí.
B. cháy trong khí oxi nguyên chất.
C. cháy trong hỗn hợp khí oxi và khí nitơ.
D. cháy trong hỗn hợp khí oxi và khí cacbonic.
Câu hỏi 122 :
A. Bột CaO.
A. Bột CaO.
B. Dung dịch NaOH đặc.
C. Bột Na2CO3khan.
D. Dung dịch H2SO4đậm đặc
Câu hỏi 124 :
A. Tính axit mạnh.
A. Tính axit mạnh.
B. Tính oxi hoá mạnh.
C. Tính háo nước.
D. Tính axit và tính oxi hoá mạnh.
Câu hỏi 125 :
A. 0,0003 mol/l.s.
A. 0,0003 mol/l.s.
B. 0,00025 mol/l.s.
C. 0,00015 mol/l.s.
D.0,0002 mol/l.s.
Câu hỏi 126 :
A. H2S+ Pb(NO3)2→ 2HNO3+ PbS↓
A. H2S+ Pb(NO3)2→ 2HNO3+ PbS↓
B. 2H2S + 4Ag + O2→ 2Ag2S + 2H2O
C. 3H2S + 2KMnO4→ 2MnO2 +2KOH + 3S↓ +2H2O
D. 2Na + 2H2S → 2NaHS + H2↑
Câu hỏi 130 :
N2 (k) + 3H2 (k) ⇄ 2NH3 (k) 
A. Tăng nhiệt độ và cho chất xúc tác.
B. Giảm áp suất và tăng nồng độ NH3.
C. Điều chỉnh để nồng độ N2bằng nồng độ H2.
D. Tăng áp suất, giảm nhiệt độ và lấy NH3ra khỏi phản ứng.
Câu hỏi 132 :
A. Fe2O3, KMnO4, Fe, Cu(OH)2, AgNO3.
A. Fe2O3, KMnO4, Fe, Cu(OH)2, AgNO3.
B. KMnO4, CuSO4, Fe, Fe3O4, Mg(OH)2.
C. Fe, CuO, H2SO4, AgNO3, Mg(OH)2.
D. Fe2O3, KMnO4, Cu, Fe(OH)3, AgNO3.
Câu hỏi 140 :
A.Nhiệt độ thấp.
A.Nhiệt độ thấp.
B.Trong bóng tối.
C.Có chiếu sáng.
D.Trong bóng tối, nhiệt độ thường.
Câu hỏi 144 :
B. Ozon là chất khí có mùi đặc trưng.
B. Ozon là chất khí có mùi đặc trưng.
C. Ozon là chất có tính oxi hoá mạnh.
D. Ozon không tác dụng được với nước.
Câu hỏi 145 :
A.Rót từ từ axit vào nước và khuấy nhẹ.
A.Rót từ từ axit vào nước và khuấy nhẹ.
B.Rót từ từ nước vào axit và khuấy nhẹ.
C.Rót từ từ axit vào nước và đun nhẹ.
D.Rót từ từ nước vào axit và đun nhẹ.
Câu hỏi 147 :
A. (1), (2), (3), (4).
A. (1), (2), (3), (4).
B. (1), (3), (5).
C. (2), (3), (4), (5).
D. (1), (2), (3), (4), (5).
Câu hỏi 148 :
A.N2 (k) + 3H2 (k)⇄ 2NH3 (k).
A.N2 (k) + 3H2 (k)⇄ 2NH3 (k).
B.N2 (k)+ O2(k) ⇄ 2NO(k).
C.2NO (k)+ O2(k) ⇄ 2NO2(k).
D.2SO2 (k)+ O2(k) ⇄ 2SO3 (k).
Câu hỏi 149 :
A.Các phản ứng hoá học xảy ra với tốc độ như nhau.
A.Các phản ứng hoá học xảy ra với tốc độ như nhau.
B.Tốc độ phản ứng hoá học là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
C.Tốc độ phản ứng là độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
D.Tốc độ phản ứng được xác định theo thời gian.
Câu hỏi 150 :
A.dung dịch hiện màu xanh.
A.dung dịch hiện màu xanh.
B.dung dịch hiện màu vàng lục.
C.có kết tủa màu trắng.
D.có kết tủa màu vàng nhạt.
Câu hỏi 152 :
A.Cho dung dịch HF tác dụng với MnO2đun nóng.
A.Cho dung dịch HF tác dụng với MnO2đun nóng.
B.Oxi hoá HF bằng oxi không khí.
C.Điện phân nóng chảy hỗn hợp HF và KF với anốt bằng thép hoặc đồng.
D.Đun CaF2với H2SO4đậm đặc.
Câu hỏi 154 :
4Ag + 2H2S + O2→ 2Ag2S + 2H2O. Kết luận nào sau đây đúng?
A.Ag là chất oxi hóa.
B.H2S là chất khử.
C.Ag là chất khử.
D.O2là chất khử.
Câu hỏi 156 :
A.Nhiệt độ của ngọn lửa axetilen cháy trong oxi cao hơn nhiều so với cháy trong không khí.
A.Nhiệt độ của ngọn lửa axetilen cháy trong oxi cao hơn nhiều so với cháy trong không khí.
B.Nấu thực phẩm trong nồi áp suất nhanh chín hơn so với khi nấu chúng ở áp suất thường.
C.Các chất đốt rắn (như than, củi) có kích thước nhỏ hơn sẽ cháy nhanh hơn.
D.Nấu thực phẩm trên núi cao (áp suất thấp) thực phẩm lâu chín hơn.
Câu hỏi 160 :
A.1.10-4(mol/l.s).
A.1.10-4(mol/l.s).
B.4.10-4(mol/l.s).
C.3.10-4(mol/l.s).
D.2.10-4(mol/l.s).
Câu hỏi 165 :
- Phần 1 tác dụng với dung dịch HCl dư thu được 0,56 lít (đktc).
A. 1,120 lit.
B. 0,448 lit.
C. 0,840 lit.
D. 0,560 lit.
Câu hỏi 170 :
A. Tăng nồng độ oxi khi quạt vào than.
A. Tăng nồng độ oxi khi quạt vào than.
B. Tăng nhiệt độ để nhanh chín thức ăn.
C. Tăng áp suất của phản ứng.
D. Tăng diện tích tiếp xúc của than với oxi.
Câu hỏi 171 :
A. Diện tích bề mặt tiếp xúc.
A. Diện tích bề mặt tiếp xúc.
B. Áp suất.
C. Nhiệt độ.
D. Nồng độ.
Câu hỏi 172 :
A. Số mol các chất tham gia phản ứng không đổi.
A. Số mol các chất tham gia phản ứng không đổi.
B. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
C. Số mol các sản phẩm không đổi.
D. Phản ứng không xảy ra nữa.
Câu hỏi 176 :
A. Thay đổi nồng độ khí H2hoặc CO2.
A. Thay đổi nồng độ khí H2hoặc CO2.
B. Thay đổi nồng độ khí H2O.
C. Thay đổi nhiệt độ.
D. Thay đổi áp suất.
Câu hỏi 179 :
MnO2+ (A) → MnCl2+ (B)↑ + (C);
A. NaCl, Cl2, H2O, FeO.
B. NaCl, Cl2, H2O, Fe(OH)2.
C. HCl, Cl2, H2O, Fe.
D. HCl, H2, H2O, Fe.
Câu hỏi 182 :
A. clo hấp thụ màu.
A. clo hấp thụ màu.
B. clo có tính oxi hóa mạnh.
C. nước clo chứa HClO có tính oxi hóa mạnh, tẩy màu.
D. clo tác dụng với nước tạo ra HCl có tính tẩy màu.
Câu hỏi 183 :
Cân bằng chuyển dịch theo chiều nghịch khi
A. Giảm nồng độ Cl2.
B. Giảm áp suất.
C. Thêm PCl5.
D. Giảm nhiệt độ.
Câu hỏi 184 :
A. 6,80.10−4mol/(l.s).
A. 6,80.10−4mol/(l.s).
B. 1,36.10−3mol/(l.s).
C. 2,72.10−3mol/(l.s).
D. 6,80.10−3mol/(l.s).
Câu hỏi 185 :
A. Nước vôi trong và dung dịch Br2.
A. Nước vôi trong và dung dịch Br2.
B. Dung dịch Br2.
C. Nước vôi trong.
D. Dung dịch KMnO4.
Câu hỏi 186 :
A. Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
A. Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
D. Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
Câu hỏi 196 :
A.cộng hóa trị không cực.
A.cộng hóa trị không cực.
B.cộng hóa trị có cực.
C.ion.
D.hiđro.
Câu hỏi 200 :
Na2S2O3+ H2SO4→ Na2SO4+ S↓ + SO2+ H2O
A.Hạ nhiệt độ của phản ứng.
B.Tăng nồng độ chất phản ứng.
C. Cho thêm dung dịch muối Na2SO4.
D.Lọc lấy kết tủa.
Câu hỏi 201 :
D. nhiều trong muối iotua, hiếm hơn muối bromua.
A.bán kính lớn hơn, độ âm điện nhỏ hơn.
B.bán kính nhỏ hơn, độ âm điện lớn hơn.
C.màu đen tím, dễ tan trong nước.
Câu hỏi 204 :
A.Fe2(SO4)3; SO2và H2O.
A.Fe2(SO4)3; SO2và H2O.
B.FeSO4và H2O.
C.Fe2(SO4)3; H2O.
D.FeSO4; SO2và H2O.
Câu hỏi 205 :
A.Dung dịch H2SO4làm quỳ tím hóa đỏ.
A.Dung dịch H2SO4làm quỳ tím hóa đỏ.
B.SO2được dùng để sản xuất H2SO4trong công nghiệp.
C.SO2là chất khí không màu, mùi trứng thối, nặng hơn không khí.
D.Dung dịch H2S bị vẩn đục màu vàng khi để ngoài không khí.
Câu hỏi 207 :
A.thay đổi áp suất chung của hệ.
A.thay đổi áp suất chung của hệ.
B.tăng nồng độ của HI.
C.tăng nhiệt độ của hệ.
D.thay đổi nồng độ của H2.
Câu hỏi 211 :
A. SO2+ Br2+ 2H2O → H2SO4+ 2HBr.
A. SO2+ Br2+ 2H2O → H2SO4+ 2HBr.
B. SO2+ H2O  H2SO3.
H2SO3.
C. SO2+ 2H2S → 3S↓ + 2H2O.
D. SO2+ 2NaOH → Na2SO3+ H2O.
Câu hỏi 213 :
A.Có thể phân biệt hai dung dịch NaCl và H2SO4bằng BaCl2.
A.Có thể phân biệt hai dung dịch NaCl và H2SO4bằng BaCl2.
B.Ở nhiệt độ thường, khí oxi phản ứng được với tất cả kim loại.
C.Đốt cháy FeS trong lượng dư khí oxi thì thu được FeO và SO2.
D.Dung dịch H2SO4 loãng hòa tan được cacbon và lưu huỳnh.
Câu hỏi 215 :
A. Cho 1 molKMnO4 tác dụng với lượng dư dung dịch HCl đặc.
A. Cho 1 molKMnO4 tác dụng với lượng dư dung dịch HCl đặc.
B. Cho 1 molCaCO3tác dụng với lượng dư dung dịch HCl loãng.
C. Đun nóng 1 mol KMnO4 ở nhiệt độ cao.
D. Cho 1 mol Al vào dung dịch H2SO4loãng.
Câu hỏi 223 :
A. -2, -4, -6, 0.
A. -2, -4, -6, 0.
B. -1, 0, +2, +4.
C. -4, -2, +6, +8.
D. -2, 0, +4, +6.
Câu hỏi 231 :
A. FeSO4 , SO2, H2O.
A. FeSO4 , SO2, H2O.
B. Fe2(SO4)3, H2O.
C. FeSO4, H2O.
D. Fe2(SO4)3, SO2, H2O.
Câu hỏi 234 :
A. nhiệt phân KClO3có MnO2xúc tác.
A. nhiệt phân KClO3có MnO2xúc tác.
B. điện phân nước.
C. chưng cất phân đoạn không khí lỏng.
D. điện phân dung dịch NaOH.
Câu hỏi 238 :
a. Viết phương trình phản ứng
a. Viết phương trình phản ứng
b. Thành phần % khối lượng của Fe và Cu trong hỗn hợp.
Câu hỏi 240 :
A. Tính axit giảm, tính khử giảm.
A. Tính axit giảm, tính khử giảm.
B. Tính axit tăng, tính khử giảm.
C. Tính axit giảm, tính khử tăng.
D. Tính axit tăng, tính khử tăng.
Câu hỏi 243 :
A. Cho dung dịch Na2SO3+ dung dịch H2SO4đặc.
A. Cho dung dịch Na2SO3+ dung dịch H2SO4đặc.
B. Đốt cháy hoàn toàn khí H2S trong không khí.
C. Cho Na2SO3tinh thể + dung dịch H2SO4(đun nóng).
D. Cho lưu huỳnh cháy trong không khí.
Câu hỏi 245 :
A. cho từ từ axit vào nước và khuấy đều.
A. cho từ từ axit vào nước và khuấy đều.
B. cho từ từ nước vào axit và khuấy đều.
C. cho nhanh nước vào axit và khuấy đều.
D. cho nhanh axit vào nước và khuấy đều.
Câu hỏi 247 :
A. S → H2S → SO2→ H2SO4.
A. S → H2S → SO2→ H2SO4.
B. FeS2→ SO2→ H2S → H2SO4.
C. FeS2→ S → SO2→ SO3→ H2SO4.
D. S → SO2→ SO3→ H2SO4.
Câu hỏi 250 :
A. tính khử mạnh.
A. tính khử mạnh.
B. tính oxi hóa yếu.
C. tính khử yếu.
D. tính oxi hóa mạnh.
Câu hỏi 251 :
A. Giấy quì từ màu tím chuyển sang màu xanh.
A. Giấy quì từ màu tím chuyển sang màu xanh.
B. Giấy quì từ màu xanh chuyển sang không màu.
C. Giấy quì từ màu xanh chuyển sang màu hồng.
D. Giấy quì từ màu xanh chuyển sang màu tím.
Câu hỏi 256 :
A. Tất cả các muối AgX (X là halogen) đều không tan.
A. Tất cả các muối AgX (X là halogen) đều không tan.
B. Các hidro halogenua tác dụng trực tiếp với hầu hết các kim loại.
C. Các hidro halogenua ở điều kiện thường đều là chất khí, dễ tan trong nước thành các dung dịch axit mạnh.
D. Tính axit của các axit HX tăng từ HF đến HI.
Câu hỏi 257 :
A. H2S >H2CO3 >HCl.
A. H2S >H2CO3 >HCl.
B. H2S >HCl >H2CO3.
C. HCl >H2S >H2CO3.
D. HCl >H2CO3 >H2S.
Câu hỏi 258 :
A. H2SO4vừa có tính oxi hóa, vừa có tính khử.
A. H2SO4vừa có tính oxi hóa, vừa có tính khử.
B. SO2 vừa có tính oxi hóa, vừa có tính khử.
C. SO3chỉ thể hiện tính oxi hóa.
D. H2S chỉ thể hiện tính khử.
Câu hỏi 260 :
A. nồng độ chất phản ứng bằng nồng độ của sản phẩm.
A. nồng độ chất phản ứng bằng nồng độ của sản phẩm.
B. phản ứng không xảy ra nữa dù có thêm tác động của các yếu tố bên ngoài như: nhiệt độ, nồng độ, áp suất.
C. nhiệt độ phản ứng không đổi.
D. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu hỏi 265 :
Số phân tử H2SO4 bị khử và số phân tử H2SO4tham gia tạo muối trong phương trình phản ứng trên là
A. 6 và 3.
B. 6 và 6.
C. 3 và 3.
D. 2 và 3.
Câu hỏi 272 :
A.HCl, HClO, H2O.
A.HCl, HClO, H2O.
B.NaCl, NaClO, H2O.
C.NaCl, NaClO3, H2O.
D.NaCl, NaClO4, H2O.
Câu hỏi 277 :
C. một chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
A.một chất phản ứng trong một đơn vị thời gian.
B.một sản phẩm phản ứng trong một đơn vị thời gian.
D.các chất phản ứng trong một đơn vị thời gian.
Câu hỏi 278 :
C. Các đơn chất halogen có tính chất hóa học tương tự nhau.
A.Tất cả các halogen đều tồn tại ở trạng thái khí.
B.Từ flo đến iot, tính oxi hóa của đơn chất tăng dần.
D.Trong các đơn chất halogen, F2có màu đậm nhất.
Câu hỏi 284 :
4NH3 (k) + 3O2 (k) ⇄ 2N2 (k) + 6H2O(h) 
A.tăng nhiệt độ.
B.thêm chất xúc tác.
C.tăng áp suất
D.loại bỏ hơi nước.
Câu hỏi 286 :
A. CH4, CO, NaCl.
A. CH4, CO, NaCl.
B. H2S, FeS, CaO.
C.FeS, H2S, NH3.
D.CH4, H2S, Fe2O3.
Câu hỏi 287 :
A.Ba(HCO3)2+ H2SO4→BaSO4+ 2H2O + CO2↑
A.Ba(HCO3)2+ H2SO4→BaSO4+ 2H2O + CO2↑
B. FeO +H2SO4 loãng→FeSO4 + H2O
C.Cu + 2H2SO4 đặc→CuSO4+ SO2↑+ 2H2O
D. Fe3O4+ 4H2SO4 đặc→ FeSO4+ Fe2(SO4)3+ 4H2O
Câu hỏi 289 :
Các dung dịch X, Y, Z lần lượt là
A.FeCl3, H2SO4(đặc, nóng), Ba(NO3)2.
B. FeCl3, H2SO4(đặc, nóng), BaCl2.
C. FeCl2, H2SO4(đặc, nóng), BaCl2.
D. FeCl2, H2SO4(loãng), Ba(NO3)2.
Câu hỏi 290 :
A. NaCl, SO2, Cl2.
A. NaCl, SO2, Cl2.
B. NaCl, HCl, SO2.
C. NaCl, Cl2, HCl.
D. NaCl, HCl, Cl2.
Câu hỏi 291 :
A. 6,86% và 4,73%.
A. 6,86% và 4,73%.
B. 11,28% và 3,36%.
C. 9,28% và 1,36%.
D. 15,28% và 4,36%.
Câu hỏi 296 :
A.Muối AgI không tan trong nước, muối AgF tan trong nước.
A.Muối AgI không tan trong nước, muối AgF tan trong nước.
B.Dung dịch HF hòa tan được SiO2.
C.Trong các hợp chất, ngoài số oxi hóa -1, flo và clo còn có số oxi hóa +1, +3, +5, +7.
D.Flo có tính oxi hóa mạnh hơn clo.
Câu hỏi 297 :
A.Fe + 2HCl → FeCl2+ H2↑
A.Fe + 2HCl → FeCl2+ H2↑
B.NaOH + HCl → NaCl + H2O
C.Fe + KNO3+ 4HCl → FeCl3+ KCl + NO↑ + 2H2O
D.MnO2+ 4HCl → MnCl2+ Cl2↑ + 2H2O
Câu hỏi 299 :
A.chất chỉ thị màu.
A.chất chỉ thị màu.
B.màu sắc của dung dịch.
C.dung dịch axit mạnh.
D.dung dịch muối bari hoặc dung dịch Ba(OH)2.
Câu hỏi 301 :
A.Clorua vôi không phải là muối.
A.Clorua vôi không phải là muối.
B.Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
C.Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
D.Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
Câu hỏi 302 :
A.dung dịch NaOH đặc.
A.dung dịch NaOH đặc.
B.CaO.
C.dung dịch NaCl.
D.dung dịch H2SO4đậm đặc.
Câu hỏi 303 :
B.S + 3F2 SF6
SF6
A.4S + 6NaOH(đặc) 2Na2S + Na2S2O3+ 3H2O
2Na2S + Na2S2O3+ 3H2O
C.S + Hg → HgS
D.S + 6HNO3 (đặc)  H2SO4+ 6NO2+ 2H2O
H2SO4+ 6NO2+ 2H2O
Câu hỏi 304 :
A.Điều chế oxi trong phòng thí nghiệm.
A.Điều chế oxi trong phòng thí nghiệm.
B.Sát trùng nước sinh hoạt.
C.Chữa sâu răng.
D.Tẩy trắng tinh bột, dầu ăn.
Câu hỏi 305 :
A.Brom có tính oxi hóa mạnh, tuy yếu hơn flo và clo nhưng nó cũng oxi hóa được nước.
A.Brom có tính oxi hóa mạnh, tuy yếu hơn flo và clo nhưng nó cũng oxi hóa được nước.
B.Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng nó cũng oxi hóa được nước.
C.Flo có tính oxi hóa rất mạnh, oxi hóa mãnh liệt nước.
D.Clo có tính oxi hóa mạnh, oxi hóa được nước.
Câu hỏi 306 :
A.Tính axit của HF mạnh hơn tính axit của HCl.
A.Tính axit của HF mạnh hơn tính axit của HCl.
B.Bán kính nguyên tử của clo lớn hơn bán kính nguyên tử của flo.
C.Độ âm điện của brom lớn hơn độ âm điện của iot.
D.Tính khử của ion Br mạnh hơn tính khử của ion Cl
mạnh hơn tính khử của ion Cl .
.
Câu hỏi 307 :
A.Phân hủy kali pemanganat.
A.Phân hủy kali pemanganat.
B.Phân hủy kali nitrat.
C.Điện phân nước.
D.Phân hủy kali clorat.
Câu hỏi 308 :
A.4FeS2+ 11O2 8SO2+ 2Fe2O3
8SO2+ 2Fe2O3
B.Cu + 2H2SO4 SO2+ CuSO4+ 2H2O
SO2+ CuSO4+ 2H2O
C.3S + 2KClO3 3SO2+ 2KCl
3SO2+ 2KCl
D.C + 2H2SO4 2SO2+ CO2+ 2H2O
2SO2+ CO2+ 2H2O
Câu hỏi 310 :
A.Sục khí H2S vào dung dịch CuCl2.
A.Sục khí H2S vào dung dịch CuCl2.
B.Cho Fe vào dung dịch H2SO4loãng, nguội.
C.Sục khí H2S vào dung dịch FeCl2.
D.Sục khí Cl2vào dung dịch FeCl2.
Câu hỏi 312 :
A.tính oxi hóa yếu.
A.tính oxi hóa yếu.
B.vừa có tính oxi hóa, vừa có tính khử.
C.tính oxi hóa mạnh.
D.tính khử mạnh.
Câu hỏi 313 :
A.dung dịch chuyển sang màu nâu đen.
A.dung dịch chuyển sang màu nâu đen.
B.dung dịch bị vẩn đục màu vàng rồi lại trong suốt.
C.tạo thành chất rắn màu đỏ.
D.dung dịch bị vẩn đục màu vàng.
Câu hỏi 316 :
A.6H2SO4+ 2Al 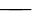 Al2(SO4)3+ 6H2O + 3SO2
Al2(SO4)3+ 6H2O + 3SO2
A.6H2SO4+ 2Al 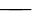 Al2(SO4)3+ 6H2O + 3SO2
Al2(SO4)3+ 6H2O + 3SO2
B.H2SO4+ Na2CO3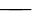 Na2SO4+ CO2+ H2O
Na2SO4+ CO2+ H2O
C.H2SO4+ Zn 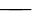 ZnSO4+ H2
ZnSO4+ H2
D.H2SO4+ Fe(OH)2 FeSO4+ 2H2O
FeSO4+ 2H2O
Câu hỏi 317 :
A.Để điều chế được 2,24 lít khí Cl2(ở đktc) với hiệu suất phản ứng là 80% thì cần một lượng dung dịch axit clohiđric đặc có chứa ít nhất 0,25 mol HCl.
A.Để điều chế được 2,24 lít khí Cl2(ở đktc) với hiệu suất phản ứng là 80% thì cần một lượng dung dịch axit clohiđric đặc có chứa ít nhất 0,25 mol HCl.
B.Để hoà tan hết 5,6 gam Fe cần một lượng vừa đủ dung dịch có chứa 0,2 mol HCl.
C.Dung dịch axit clohiđric đặc tác dụng với MnO2(không cần đun nóng) tạo ra khí clo.
D.Axit clohiđric hoà tan được Al, Zn, CaCO3, BaSO3, đồng thời giải phóng ra chất khí không màu.
Câu hỏi 321 :
A.(2), (3), (5).
A.(2), (3), (5).
B.(1), (2), (4).
C.(1), (2), (4), (5).
D.(2), (3), (4), (6).
Câu hỏi 328 :
Phần 1: Cho tác dụng với dung dịch H2SO4loãng, dư thì thu được 4,48 lít khí (đktc).
A. 10,4.
B. 8,0.
C. 16.
D. 5,2.
Câu hỏi 329 :
A. HCl, HBr, HI, HF.
A. HCl, HBr, HI, HF.
B. HI, HBr, HCl, HF.
C. HF, HCl, HBr, HI.
D. HBr, HI, HF, HCl.
Câu hỏi 337 :
A. 61,6% và 38,4%.
A. 61,6% và 38,4%.
B. 50,0% và 50,0%.
C. 44,5% và 55,5%.
D. 40% và 60%.
Câu hỏi 338 :
A. HCl dễ bay hơi, hút ẩm tạo ra các giọt nhỏ axit HCl.
A. HCl dễ bay hơi, hút ẩm tạo ra các giọt nhỏ axit HCl.
B. HCl đã tan trong nước đến mức bão hòa.
C. HCl phân hủy tạo thành H2và Cl2.
D. HCl dễ bay hơi tạo thành.
Câu hỏi 339 :
A. Dung dịch AgNO3, quỳ tím.
A. Dung dịch AgNO3, quỳ tím.
B. Phenolphtalein, khí clo.
C. Quỳ tím, khí clo.
D. Phenolphtalein.
Câu hỏi 341 :
A. NaOH + HCl → NaCl + H2O.
A. NaOH + HCl → NaCl + H2O.
B. 2KMnO4+ 16HCl 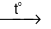 2MnCl2+ 2KCl + 5Cl2+ 8H2O.
2MnCl2+ 2KCl + 5Cl2+ 8H2O.
C. Fe + 2HCl → FeCl2+ H2↑.
D. Fe(OH)2+ 2HCl → FeCl2+ 2H2O.
Câu hỏi 342 :
A. Ag, Ba, Fe, Zn.
A. Ag, Ba, Fe, Zn.
B. Cu, Zn, Na, Al.
C. Mg, Cu, Ba, Zn.
D. Au, Al, Pt, Mg.
Câu hỏi 345 :
A. Dung dịch HCl.
A. Dung dịch HCl.
B. Dung dịch AgNO3.
C. Bột thủy tinh.
D. Hồ tinh bột.
Câu hỏi 346 :
A. FeS, K2SO3, Ag.
A. FeS, K2SO3, Ag.
B. CaSO3, CaCO3, Cu.
C. FeS, FeCO3, CaSO3.
D. FeS, Cu, KNO3.
Câu hỏi 347 :
A. Có khí màu vàng lục thoát ra.
A. Có khí màu vàng lục thoát ra.
B. Có kết tủa màu trắng.
C. Có khí không màu thoát ra.
D. Không có hiện tượng.
Câu hỏi 351 :
A. Không là chất oxi hóa, không là chất khử.
A. Không là chất oxi hóa, không là chất khử.
B. Chất khử.
C. Chất oxi hóa và chất khử.
D. Chất oxi hóa.
Câu hỏi 354 :
A. H2SO4>H2SO3>H2S.
A. H2SO4>H2SO3>H2S.
B. H2SO4>H2S >H2SO3.
C. H2S >H2SO4>H2SO3.
D. H2S >H2SO3>H2SO4.
Câu hỏi 355 :
A. Quỳ tím, dung dịch AgNO3.
A. Quỳ tím, dung dịch AgNO3.
B. dung dịch Na2CO3, dung dịch HNO3.
C. dung dịch Na2CO3, dung dịch H2SO4.
D. dung dịch AgNO3, dung dịch H2SO4.
Câu hỏi 357 :
A. dung dịch nước Br2.
A. dung dịch nước Br2.
B. dung dịch NaOH.
C. dung dịch NH3.
D. dung dịch Ca(OH)2.
Câu hỏi 359 :
A. HCl đặc + KClO3.
A. HCl đặc + KClO3.
B. HCl đặc + SO3.
C. HCl đặc + MnO2.
D. HCl đặc + KMnO4.
Câu hỏi 361 :
A. Phản ứng với H2mạnh dần lên.
A. Phản ứng với H2mạnh dần lên.
B. Các axit HX (X là halogen) mạnh dần lên.
C. Nhiệt độ nóng chảy tăng dần.
D. Tính oxi hoá và độ âm điện giảm dần.
Câu hỏi 362 :
A. cho nước vào axit hoặc ngược lại.
A. cho nước vào axit hoặc ngược lại.
B. đổ mạnh nước vào axit.
C. cho từ từ axit vào nước.
D. cho từ từ nước vào axit.
Câu hỏi 363 :
A. CO2và SO2đều làm đục nước vôi trong.
A. CO2và SO2đều làm đục nước vôi trong.
B. CO2 và SO2đều làm mất màu dung dịch Br2.
C. CO2 và SO2đều có thể tạo thành hai muối.
D. CO2 và SO2đều tác dụng với CaO.
Câu hỏi 367 :
A. Sục hỗn hợp khí qua dung dịch nước vôi trong dư.
A. Sục hỗn hợp khí qua dung dịch nước vôi trong dư.
B. Trộn hỗn hợp khí với khí H2S dư.
C. Sục hỗp hợp khí qua dung dịch thuốc tím dư.
D. Sục hỗn hợp khí qua dung dịch nước muối dư.
Câu hỏi 368 :
A. dung dịch AgNO3.
A. dung dịch AgNO3.
B. dung dịch FeCl3.
C. dung dịch HCl và khí O2.
D. dung dịch H2SO4đặc.
Câu hỏi 369 :
A. HCl, KCl, KClO3, H2O.
A. HCl, KCl, KClO3, H2O.
B. NaCl, NaClO, NaOH, H2O.
C. CaOCl2, CaCl2, Ca(OH)2, H2O.
D. HClO, HCl, Cl2, H2O.
Câu hỏi 373 :
A. Na2SO3= 37,8g; NaHSO3= 41,6g.
A. Na2SO3= 37,8g; NaHSO3= 41,6g.
B. Na2SO3= 41,6g; NaHSO3= 37,8g.
C. Na2SO3= 37,8g; NaHSO3= 46,6g.
D. Na2SO3= 37,8g; NaHSO3= 46,1g.
Câu hỏi 375 :
(2,5 điểm)
a. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu và nồng độ mol dung dịch H2SO4đã dùng.
b. Nếu cho 8g hỗn hợp trên tác dụng với H2SO4đặc, nguội thì thể tích khí SO2(đktc) thu được là bao nhiêu lít?
Câu hỏi 376 :
(1,5 điểm).
a. Cho biết chiều thuận của phản ứng là thu nhiệt hay toả nhiệt? Vì sao?
b. Cho biết chiều chuyển dịch của cân bằng trên khi:
Câu hỏi 379 :
A.HCl, HClO, H2O.
A.HCl, HClO, H2O.
B.NaCl, NaClO, H2O.
C.NaCl, NaClO3, H2O.
D.NaCl, NaClO4, H2O.
Câu hỏi 382 :
A.Để cục đá vôi to và dùng dung dịch HCl 2M.
A.Để cục đá vôi to và dùng dung dịch HCl 2M.
B.Để cục đá vôi to và dùng dung dịch HCl 1M.
C.Nghiền nhỏ đá vôi và dùng dung dịch HCl 1M.
D.Nghiền nhỏ đá vôi và dùng dung dịch HCl 2M.
Câu hỏi 383 :
Khi thêm vào hệ một lượng khí CO2: cân bằng chuyển dịch theo chiều ..........
A.Thuận
B.Nghịch
Câu hỏi 390 :
A. -2, -4, +6, +8.
A. -2, -4, +6, +8.
B. -1, 0, +2, +4.
C. -2, 0, +4, +6.
D. -2, -4, -6, 0.
Câu hỏi 394 :
A. chuyển sang màu xanh.
A. chuyển sang màu xanh.
B. chuyển sang không màu.
C. chuyển sang màu đỏ.
D. không chuyển màu.
Câu hỏi 396 :
A. NaCl, H2O.
A. NaCl, H2O.
B. NaCl, NaClO3, H2O.
C. NaCl, NaClO, Cl2, H2O.
D. NaCl, NaClO, H2O.
Câu hỏi 399 :
A. 4, 5, 4, 1, 4.
A. 4, 5, 4, 1, 4.
B. 5, 4, 4, 4, 1.
C. 4, 4, 5, 1, 4.
D. 1, 4, 4, 4, 5.
Câu hỏi 400 :
A. +1, –1, +5, 0, +3.
A. +1, –1, +5, 0, +3.
B.–1, +1, +5, 0, +7.
C. –1, +1, +3, 0, +7.
D. –1, +3, +5, 0, +7.
Câu hỏi 402 :
A. để hàn, cắt kim loại.
A. để hàn, cắt kim loại.
B. trong công nghiệp hoá chất.
C. để luyện thép.
D. để làm nhiên liệu tên lửa.
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK

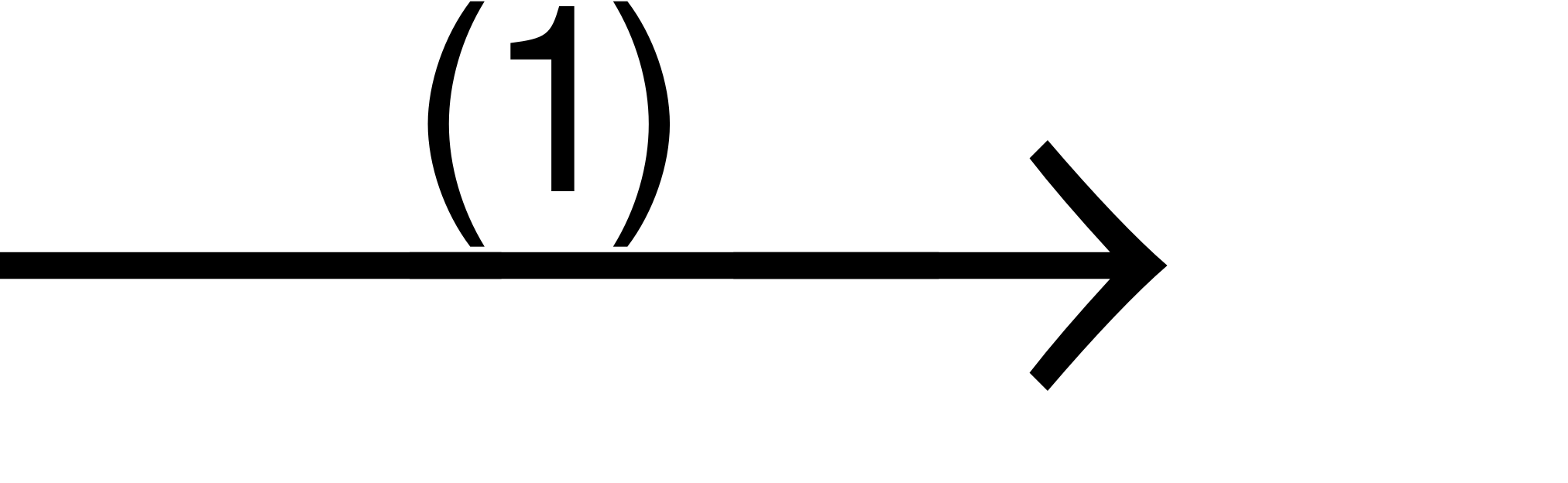 Cl2
Cl2 NaCl
NaCl  HCl
HCl  FeCl2
FeCl2
 H2S
H2S  SO2
SO2 SO3
SO3 H2SO4
H2SO4 CuSO4.
CuSO4.