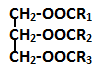Hoá học 12 Bài 4: Luyện tập Este và Chất béo
Tóm tắt bài
Kiến thức cần nắm
| Este | Lipit | |
| Khái niệm | Khi thay thế nhóm OH của nhóm cacboxyl trong phân tử axit cacboxylic bằng nhóm OR ta thu được hợp chất este.(R là gốc hidrocacbon). | Là trieste của axit béo có mạch cacbon dài với glixerol. |
| Công thức |
Este no,đơn chức, mạch hở: CnH2nO2 \((n\geq 2)\) Vd: CH3COOCH3 : Metyl axetat |
CTCT: vd: (C17H35COO)3C3H5 :Tristearin |
| Tính chất hóa học |
+Thủy phân trong môi trường H+(tác dụng với nước) +Thủy phân trong môi trường OH- +Phản ứng cháy |
+Thủy phân trong môi trường H+(tác dụng với nước) +Thủy phân trong môi trường OH- +Phản ứng hidro hóa chất béo lỏng |
3.1. Bài tập Este, Lipit - Cơ bản
Bài 1:
Để thủy phân hoàn toàn m gam este đơn chức X cần dùng vừa hết 200ml dung dịch NaOH 0,25M, sau phản ứng thu được 2,3 gam ancol và 3,4 gam muối. Công thức của X là
Hướng dẫn:
Áp dụng định luật bảo toàn khối lượng:
\(\begin{array}{l} {\rm{ }}{m_{{\rm{este}}}} + {m_{NaOH}} = {m_{Ancol}} + {m_{mu{\rm{o}}i}}\\ \Leftrightarrow {m_{{\rm{este}}}} = 2,3 + 3,4 - 2,3 = 3,7(gam) \end{array}\)
Vì phản ứng xảy ra vừa đủ nên: \({n_{NaOH}} = {n_{{\rm{es}}te}} = 0,2.0,25 = 0,05{\rm{ }}(mol)\)
\({M_{{\rm{es}}te}} = \frac{{3,7}}{{0,05}} = 74 \to HC{\rm{OO}}{{\rm{C}}_2}{H_5}\)
Bài 2:
Cho 13,2 g este đơn chức no Z tác dụng hết với 150 ml dung dịch NaOH 1M thu được 12,3 g muối. Xác định Z
Hướng dẫn:
Este Z no, đơn chức: RCOOR’
\({n_{NaOH}} = 0,15.1 = 0,15\,\,(mol)\)
RCOOR’ + NaOH → RCOONa + R’OH
0,15 ← 0,15 (mol) → 0,15
\(\begin{array}{l} \Rightarrow {M_{RCOONa}} = \frac{{12,3}}{{0,15}} = 82\\ \,\,\,\,\,\,\,\,\,\,R + 44 + 23 = 82\\ \,\,\,\,\,\,\,\,\,R\,\, = \,\,15\,\,(C{H_3}) \end{array}\)
\(\begin{array}{l} \Rightarrow {M_{RCOOR'}} = \frac{{13,2}}{{0,15}} = 88\\ \,\,\,\,\,\,\,\,15 + 44 + R' = 88\\ \,\,\,\,\,\,\,\,R'\,\, = \,\,29\,\,({C_2}{H_5}) \end{array}\)
=> Z: CH3COOC2H5
Bài 3:
Đun 6 gam CH3COOH với 9,2 gam C2H5OH (có H2SO4 đặc làm xúc tác) đến khi phản ứng đạt tới trạng thái cân bằng được 6,6 gam este. Hiệu suất phản ứng este hóa là
Hướng dẫn:
\(n_{CH_{3}COOH}=0,1mol;n_{C_{2}H_{5}OH}=0,2mol;n_{este}=0,075mol\)
\(H=\frac{0,075}{0,1}.100\%=75\%\)
Bài 4:
Đun nóng 20g một loại chất béo trung tính với dung dịch chứa 0,25 mol NaOH, để trung hòa NaOH dư cần 0,18 mol HCl. Khối lượng xà phòng 72% sinh ra từ 1 tấn chất béo trên là
Hướng dẫn:
nNaOH pứ = 0,25 – 0,18 = 0,07 mol
Phản ứng tổng quát: Chất béo + 3NaOH → 3.Muối mononatri + C3H5(OH)3
=> nglixerol = 1/3.nNaOH = 0,07/3 mol
=> mmuối = 20,653g
Với 1 tấn Chất béo thì tạo mMuối = 1032,67 kg
=> mXà phòng 72% = 1434,26 kg
3.2. Bài tập Este, Lipit - Nâng cao
Bài 1:
Cho hỗn hợp X gồm 2 este có công thức phân tử C4H8O2 và C3H6O2 tác dụng với NaOH dư thu được 6,14 gam hỗn hợp hai muối và 3,68 gam rượu Y duy nhất có tỉ khối hơi so với oxi là 1,4375. Khối lượng mỗi este trong X lần lượt là
Hướng dẫn:
Hỗn hợp este X: C4H8O2 và C3H6O2 (este no)
X + NaOH → 2 muối + 1 ancol
X có thể là:\((I)\left\{ \begin{array}{l} {\rm{C}}{{\rm{H}}_3}{\rm{COO}}{C_2}{H_5}\\ {\rm{HCOO}}{C_2}{H_5} \end{array} \right.\,\,\,\,\,\,\,\,\,\,\,(II)\left\{ \begin{array}{l} {C_2}{H_5}{\rm{COO}}C{H_3}\\ C{H_3}{\rm{COO}}C{H_3} \end{array} \right.\)
⇒ 3,68 (g) ancol Y: là C2H5OH hoặc CH3OH
\({M_Y} = {d_{Y/{O_2}}}.32 = 1,4375.32 = 46\)
⇒ Ancol là C2H5OH
⇒ Chọn trường hợp (I).
\(\left\{ \begin{array}{l} {\rm{C}}{{\rm{H}}_3}{\rm{COO}}{C_2}{H_5}\,\,a\,\,(mol)\\ {\rm{HCOO}}{C_2}{H_5}\,\,\,\,\,\,\,b\,\,\,\,(mol) \end{array}\overset{NaOH}{\rightarrow} \right.6,14\,\,(g)\left\{ \begin{array}{l} C{H_3}{\rm{COO}}Na\,\,a\,\,(mol)\\ HCOONa\,\,\,\,\,\,\,b\,\,(mol) \end{array} \right. + \left\{ \begin{array}{l} 3,68\,(g)\,\,\,{C_2}{H_5}OH\\ \,\,\,\,\,a\,\, + \,\,\,\,b\,\,\,\,\,(mol) \end{array} \right.\)
Ta có:
\(\begin{array}{l} \left\{ \begin{array}{l} 82a + 68b = 6,14\\ (a + b)46 = 3,68 \end{array} \right.\\ \left\{ \begin{array}{l} a = 0,05\\ b = 0,03 \end{array} \right.\\ \Rightarrow {m_{C{H_3}{\rm{COO}}{C_2}{H_5}}} = 88.0,05 = 4,4\,\,(g)\\ \Rightarrow {m_{HC{\rm{OO}}{C_2}{H_5}}} = 74.0,03 = 2,22\,\,(g) \end{array}\)
4. Luyện tập Bài 4 Hóa học 12
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 4 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Hai muối và hai ancol
- B. Hai muối và một ancol
- C. Một muối và hai ancol
- D. Một muối và một ancol
-
- A. 5.
- B. 2.
- C. 4.
- D. 3.
-
- A. C15H31COONa và etanol.
- B. C17H35COOH và glixerol.
- C. C15H31COONa và glixerol
- D. C17H35COONa và glixerol.
-
- A. 42,3%.
- B. 57,7%.
- C. 88%.
- D. 22%.
-
- A. 0,015.
- B. 0,010.
- C. 0,020.
- D. 0,005.
-
Câu 6:
X là một este của glixerol với axit đơn chức Y. Công thức đơn giản nhất của X là C3H4O3. Axit Y là:
- A. Axit crylic
- B. Axit fomic
- C. Axit benzoic
- D. Axit axetic
-
- A. 4.
- B. 2.
- C. 3.
- D. 5.
-
- A. CH3COOC2H5.
- B. C2H3COOC2H5.
- C. C2H5COOCH3.
- D. C2H5COOC2H5.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao Chương 1 Bài Luyện tập Este và Chất béo
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 4.
Bài tập 4.1 trang 8 SBT Hóa học 12
Bài tập 4.2 trang 8 SBT Hóa học 12
Bài tập 4.3 trang 8 SBT Hóa học 12
Bài tập 4.4 trang 9 SBT Hóa học 12
Bài tập 4.5 trang 9 SBT Hóa học 12
Bài tập 3 trang 22 SGK Hóa học 12 nâng cao
Bài tập 4.6 trang 9 SBT Hóa học 12
Bài tập 5 trang 23 SGK Hóa học 12 nâng cao
Bài tập 4.7 trang 10 SBT Hóa học 12
Bài tập 8 trang 23 SGK Hóa học 12 nâng cao
Bài tập 4.8 trang 10 SBT Hóa học 12
Bài tập 4.9 trang 10 SBT Hóa học 12
5. Hỏi đáp về Bài 4: Luyện tập Este và Chất béo
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 12
Lớp 12 - Năm cuối ở cấp tiểu học, năm học quan trọng nhất trong đời học sinh trải qua bao năm học tập, bao nhiêu kì vọng của người thân xung quanh ta. Những nỗi lo về thi đại học và định hướng tương lai thật là nặng. Hãy tin vào bản thân là mình sẽ làm được rồi tương lai mới chờ đợi các em!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK