Hoá học 11 Bài 44: Anđehit - Xeton
Tóm tắt bài
1.1. ANĐEHIT
1.1.1. Định nghĩa, Phân loại, Danh pháp
a. Định nghĩa
- Là hợp chất hữu cơ phân tử có chứa nhóm –CH=O liên kết trực tiếp với gốc hidrocacbon hay nguyên tử H
- Nhóm-CHO là nhóm chức của andehit, được gọi là nhóm cacbandehit.
- Ví dụ: HCH=O,CH3CH=O
b. Phân loại
Dựa vào đặc điểm cấu tạo của gốc Hidrocacbon và số nhóm chức -CH=O chia thành:
- Anđehit no, mạch hở, đơn chức như HCHO; CH3CHO,...Có công thức tổng quát: CnH2n+1CHO (x \(\geq\) 0) hay CnH2nO (n \(\geq\) 1)
- Anđehit không no
- Anđehit thơm
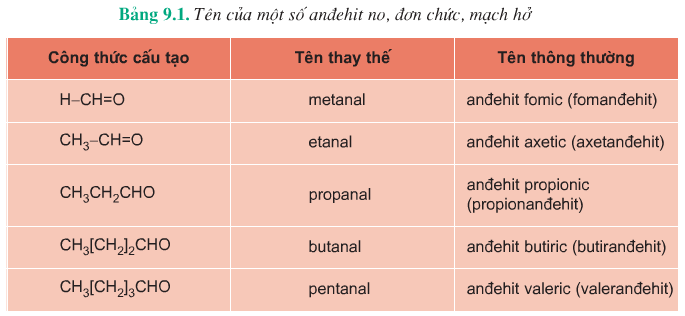
c. Danh pháp
Cách gọi tên Anđehit bằng tên thay thế:
- Bước 1: Chọn mạch C dài nhất chứa nhóm -CHO làm mạch chính.
- Bước 2: Đánh số từ Cacbon ở nhóm chức -CHO
- Bước 3: Hidrocacbon tương ứng + al
Ví dụ:
1.1.2. Đặc điểm cấu tạo. Tính chất vật lí.
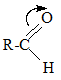
a. Đặc điểm cấu tạo
Liên kết C=O gồm 1 liên kết xích ma(\(\sigma\)) bền và 1 liên kết pi (\(\pi\)) kém bền hơn ⇒ Có tính chất giống anken (tham gia phản ứng cộng, phản ứng oxi hóa)
b. Tính chất vật lí
-
HCHO, CH3CHO là chất khí, tan tốt trong nước, có nhiệt độ sôi thấp.
-
Các anđehit tiếp theo là chất lỏng hoặc chất rắn, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
-
Dung dịch nước của anđehit fomic được gọi là fomon. Dung dịch HCHO (37-40%) được gọi là fomalin.
-
Do anđehit không có liên kết H nên nhiệt độ sôi thấp hơn ancol tương ứng.
1.1.3. Tính chất hóa học
a. Phản ứng cộng Hidro
CH3–CH=O + H2 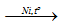
(anđehit axetic) (ancol etylic)
b. Phản ứng oxi hóa không hoàn toàn.
- Các em tiến hành quan sát thí nghiệm tráng bạc của anđehit fomic sau:
- Hiện tượng: Có kết tủa trắng. Khi ngâm dung dịch trong cốc nước nóng một thời gian thì thấy trên thành ống nghiệm có bám một lớp kim loại trắng sáng, có thể soi gương được.
- Giải thích: HCHO + 2AgNO3 + H2O + 3NH3 → HCOONH4 + 2NH4NO3 + 2Ag\(\downarrow\)
- Nhận xét: Anđehit vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
- Khi bị khử, anđehit chuyển thành ancol bậc I tương ứng.
- Khi bị oxi hóa, anđehit chuyển thành axit cacboxylic (hoặc muối của axit cacboxylic) tương ứng.
1.1.4. Điều chế
a. Từ ancol
R – CH2OH + CuO \(\overset{t^{0}}{\rightarrow}\) R – CHO + Cu + H2O
Ví dụ: CH3–CH2OH + CuO \(\overset{t^{0}}{\rightarrow}\) CH3CHO + Cu + H2O
b. Từ Hidrocacbon
- Từ Metan: CH4 + O2 \(\overset{xt,t^{0}}{\rightarrow}\) H-CH=O + H2O
(Fomanđehit)
- Từ Etilen: 2CH2 = CH2 + O2 \(\overset{xt,t^{0}}{\rightarrow}\) 2 CH3 – CH=O
(Axetanđehit)
1.1.5. Ứng dụng
- Là nguyên liệu sản xuất nhựa phenol - formanđehit, nhựa urê - formanđehit
- Nước của formanđehit (fomon) dùng để tẩy uế, làm chất sát trùng...
- Anđehit axetic dùng sản xuất axit axetic làm nguyên liệu cho nhiều ngành sản xuất
1.2. XETON
1.2.1. Định nghĩa
- Là hợp chất hữu cơ có chứa nhóm >C=O liên kết trực tiếp với 2 gốc hidrocacbon
- Ví dụ: CH3COCH3 (đimetylxeton hoặc axeton), CH3COC6H5 (Metyl phenyl xeton hoặc axeton phenon)
1.2.2. Tính chất hóa học
CH3–CO–CH3 + H2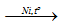
Khác với anđehit, xeton không tham gia phản ứng tráng bạc.
1.2.3. Điều chế
a. Từ ancol
R – CH(OH) – R’ + CuO \(\overset{t^{0}}{\rightarrow}\) R – CO – R’ + Cu + H2O
Ví dụ: CH3–CO–CH3 +CuO \(\overset{t^{0}}{\rightarrow}\) CH3–CHOH–CH3 + Cu+ H2O
b. Từ Hidrocacbon
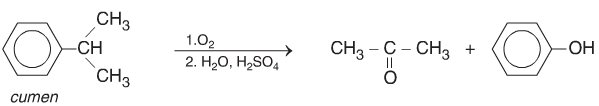
Oxi hóa không hoàn toàn Cumen thu được axeton và Phenol theo sơ đồ:
1.2.4. Ứng dụng
Axeton làm dung môi hoà tan được nhiều chất hữu cơ.
2.1. Bài tập Anđehit - Xeton - Cơ bản
Bài 1:
Cho andehit no, mạch hở, có công thức CnHmO2. Mối quan hệ giữa n với m là:
Hướng dẫn:
Andehit no mạch hở CnHmO2 có hai nhóm -CHO \(\Rightarrow \sum n \ lk \ \pi = 2\)
\(\\ \Delta =\frac{2x+2-y}{2} \Rightarrow 2\frac{2n+2-m}{2} \\ 4 = 2n+2-m \Rightarrow m = 2n - 2\)
Bài 2:
Chia hỗn hợp X gồm hai andehit no, đơn chức, mạch hở thành hai phần bằng nhau:
- Phần 1: Đem đốt cháy hoàn toàn thu được 0,54 gam H2O.
- Phần 2: Cho tác dụng hết với H2 dư (Ni, t0) thu được hỗn hợp Y. Đốt cháy hoàn toàn hỗn hợp Y, thu được V lít CO2 (đktc).
Giá trị của V là:
Hướng dẫn:
Gọi CTTQ: \(C_{\bar{n}}H_{2\bar{n}+1}CHO\)
TN1: \(C_{\bar{n}}H_{2\bar{n}+1}CHO +O_2 \rightarrow (\bar{n}+1)H_2O\)
TN2: \(C_{\bar{n}}H_{2\bar{n}+1}CHO \xrightarrow[2+O_2]{1+H_2}(\bar{n}+1)CO_2\)
\(\Rightarrow n_{CO_2} = n_{H_2O} = 0,03\ mol\)
\(\Rightarrow V_{CO_2} = 0,672 \ (l)\)
Bài 3:
Cho 14,6 gam hỗn hợp 2 andehit đơn chức, no, đồng đẳng kế tiếp tác dụng hết với H2 tạo ra 15,2 gam hỗn hợp hai ancol.Vậy công thức hai ancol là:
Hướng dẫn:
Theo định luật bảo toàn khối lượng ta có:
\(n_{H_{2}}=\frac{15,2-14,6}{2}=0,3(mol)\)
Anđehit no, đơn chức cộng hidro theo tỉ lệ 1:1 nên :
\(n_{andehit}=n_{H_{2}}=0,3(mol)\)
\(\Rightarrow M=\frac{14,6}{0,3}\approx 48,67\)
→ Hai andehit là CH3CHO và C2H5OH
Bài 4:
Cho hỗn hợp HCHO và H2 đi qua ống đựng bột Ni nung nóng, thu được hỗn hợp X. Dẫn toàn bộ sản phẩm thu được vào bình đựng nước lạnh thấy khối lượng bình tăng 11,8 gam.Lấy toàn bộ dung dịch trong bình cho tác dụng dung dịch AgNO3 trong dung dịch NH3 dư tạo ra 21,6 gam Ag. Khối lượng ancol có trong X là:
Hướng dẫn:
Ancol thu được là CH3OH
Khối lượng bình nước tăng bao gồm khối lượng của CH3OH và HCHO dư
Khi cho toàn bộ dung dịch trong bình vào AgNO3/NH3 chỉ có HCHO tác dụng
\(n_{HCHO}=\frac{1}{4}n_{Ag}=0,05gam\)
\(\Rightarrow m_{HCHO}=1,5 gam\)
\(m_{CH_{3}OH}=11,8-1,5=10,3gam\)
2.2. Bài tập Anđehit - Xeton - Nâng cao
Bài 1:
Hỗn hợp T gồm hai andehit no mạch hở:
Thí nghiệm 1: Đốt cháy hoàn toàn a mol hỗn hợp T thu được a mol H2O
Thí nghiệm 2: Hidro hóa a mol hỗn hợp T cần 1,4a mol H2
Nếu cho m gam T tác dụng với một lượng dung dịch AgNO3/NH3 thu được 1 mol Ag thì m có giá trị:
Hướng dẫn:
T: 2 andehit no, mạch hở
\(\\ C_{\overline{x}}H_{\overline{y}}O_{\overline{z}} \xrightarrow[]{\ \ \ \ \ } \frac{\overline{y}}{2}H_{2}O \\ a \ \ \ \ \rightarrow \ \ \ \ \ \ \ \ \frac{a\overline{y}}{2} = a \\ \overline{y} = 2\)
\(\\ \begin{matrix} HCHO \\ x \end{matrix} \ \ \ \ \ \ \begin{matrix} HOC-CHO \\ y \end{matrix}\)
\(\\ HCHO + H_{2} \rightarrow CH_{3}OH \\ x \ \ \ \ \ \rightarrow \ \ \ y \\ HOC-CHO+ 2H_{2} \rightarrow HO-CH_{2}-CH_{2}-OH \\ y \ \ \ \ \ \ \rightarrow \ \ 2y \\ \left.\begin{matrix} x + y = a \ \ \ \ \ \ \\ x + 2y = 1,4a \end{matrix}\right\}\frac{x}{y}=\frac{3}{2} \\ HCHO \rightarrow 4Ag \\ 3t \ \ \ \ \ \rightarrow \ \ \ 12t \\ HOC-CHO \rightarrow 4Ag \\ 2t \ \ \ \ \ \ \ \ \ \ \rightarrow \ \ \ \ \ \ \ 8t \\ n_{Ag} = 1 \ mol = 20 t \\ t = \frac{1}{20} = 0,05 \ mol \\ m = 30.3.0,05+58.2.0,05 = 10,3 \ gam\)
Bài 2:
Hỗn hợp X gồm H2 và 2 anđehit (no, đơn chức, mạch hở, M < 88). Tỉ khối của X so với Heli là 5,1534. Đun nóng hỗn hợp X (có xúc tác thích hợp) đến phản ứng hoàn toàn, thu được hỗn hợp Y có tỉ khối so với Heli là 10,3068. Nếu cho 0,88 mol X phản ứng với dung dịch AgNO3/NH3 dư, thu được m gam kết tủa. Giá trị lớn nhất của m là:
Hướng dẫn:
\(\\ \overline{M}_{hh \ X} = 5,1534 .4 = 20,6136 \\ \overline{M}_{hh \ Y} = 10,3068.4=41,2272 \\ \frac{d_{X}}{M_{Y}} = \frac{n_{Y}}{n_{X}} = \frac{1}{2}\)
⇒ Giả sử ban đầu có 0,88 mol hỗn hợp X thì sau phản ứng còn lại 0,44 mol hỗn hợp Y
⇒ ngiảm \(= n_{X} - n_{Y} = n_{H_{2}} = 0,44 \ mol\)
Mặt khac, vì andehit no, đơn chức, mạch hở, phản ứng xảy ra hoàn toàn
\(\\ \Rightarrow \sum n_{CHO} = 0,44 \ mol \\ n_{hh \ X} = 0,88.20,6136 = 18,139968 \ gam \\ m_{andehit} = 17,259968 \ gam \\ \Rightarrow \overline{M}_{hh \ andehit} = 39,2272\)
⇒ Hỗn hợp chứa HCHO (M = 30)
Đặt nHCHO = x mol; nandehit còn lại = y mol
⇒ Có hệ phương trình: \(\left\{\begin{matrix} x + y = 0,44 \ \ \ \ \ \ \ \ \ \ \ \ \ \\ 30x + M_{y} = 17,259968 \end{matrix}\right.\)
Ta có bảng sau:
Để lượng Ag kết tủa là cực đại. chọn M = 86 (C5H10O)
m = 0,3675.108.4 + 0,0725.2.108 = 174,42 gam
3. Luyện tập Bài 44 Hóa học 11
Sau bài học cần nắm:
- Định nghĩa, Phân loại, Danh pháp Anđehit - xeton
- Đặc điểm cấu tạo. Tính chất vật lí
- Tính chất hóa học
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Anđehit - Xeton có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. CH3COOH.
- B. HCOOCH3.
- C. OHC-CHO.
- D. CH2=CH-CHO.
-
- A. Etanol.
- B. Etan.
- C. Axetilen.
- D. Etilen.
-
- A. Propan-1-ol.
- B. Propan-2-ol.
- C. Xiclopropan.
- D. Cumen.
-
- A. Andehit fomic.
- B. Ancol metylic.
- C. Andehit axetic.
- D. Ancol etylic.
-
- A. HCOOH.
- B. CH3CH2OH.
- C. CH3COOH.
- D. CH3OH.
-
- A. 43,2 gam.
- B. 10,8 gam.
- C. 64,8 gam.
- D. 21,6 gam.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Anđehit - Xeton.
Bài tập 44.13 trang 70 SBT Hóa học 11
Bài tập 44.14 trang 71 SBT Hóa học 11
Bài tập 1 trang 242 SGK Hóa học 11 nâng cao
Bài tập 2 trang 243 SGK Hóa học 11 nâng cao
Bài tập 3 trang 243 SGK Hóa học 11 nâng cao
Bài tập 4 trang 243 SGK Hóa học 11 nâng cao
Bài tập 5 trang 243 SGK Hóa học 11 nâng cao
Bài tập 6 trang 243 SGK Hóa học 11 nâng cao
Bài tập 7 trang 243 SGK Hóa học 11 nâng cao
Bài tập 8 trang 243 SGK Hóa học 11 nâng cao
Bài tập 9 trang 243 SGK Hóa học 11 nâng cao
Bài tập 10 trang 244 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 44 Chương 9 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)