Hoá học 11 Bài 39: Dẫn xuất halogen của hiđrocacbon
Tóm tắt bài
1.1. Khái niệm, phân loại
1.1.1. Khái niệm
- Khi thay thế nguyên tử hidro của phân tử hidrocacbon bằng nguyên tử halogen ta được dẫn xuất halogen của hidrocacbon.
| Hidrocacbon | CH4 | CH2=CH2 | C6H6 |
| Dẫn xuất halogen | CH3Cl, CH3Br, CH2Cl2, CH2ClF | CH2=CH2-Cl | C6H5Br |
- Thay thế nhóm -OH trong phân tử ancol bằng nguyên tử Halogen
C2H5OH + HBr → C2H5Br + H2O
- Cộng hợp hidro halogenua hoặc halogen vào phân tử hidrocacbon không no.
CH2=CH2 + HBr → CH3-CH2-Br
CH2=CH2 + Br2 →
- Thế nguyên tử hidro của hidrocacbon bằng nguyên tử halogen
CH4 + Cl2 → CH3Cl + HCl (Điều kiện: ánh sáng)
1.1.2. Phân loại
- Các dẫn xuất halogen được phân loại dựa vào bản chất của halogen,số lượng nguyên tử halogen và đặc điểm cấu tạo của hidrocacbon
- Một số koại dẫn xuất halogen thường gặp:
-
Dẫn xuất halogen của hidrocacbon no, mạch hở. VD: CH3Cl (metyl clorua); CH2Cl-CH2Cl (1, 2- đicloetan)
-
Dẫn xuất halogen của hidrocacbon không no, mạch hở. VD: CH2=CHCl
-
Dẫn xuất của hidrocacbon thơm. VD: C6H5Br (Phenyl bromua)
-
-
Bậc của dẫn xuất halogen bằng bậc của nguyên tử C liên kết với nguyên tử halogen
- Bậc I:
(Etyl clorua)
- Bậc II:
(isopropyl clorua)
- Bậc III:
(tert-butyl bromua)
1.2. Tính chất vật lí
- Ở điều kiện thường, một số chất có phân tử khối nhỏ (CH3Cl, CH3F, ...) ở trạng thái khí. Các dẫn xuất có phân tử khối lớn hơn ở trạng thái lỏng và rắn.
- Hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hidrocacbon, ete, ...
- Một số dẫn xuất halogen có hoạt tính sinh học cao như CF3-CHClBr (halotan: chất gây mê, không độc), DDT (thuốc diệt côn trùng)
1.3. Tính chất hoá học
1.3.1. Phản ứng thế nguyên tử halogen bằng nhóm –OH
- Phương trình tổng quát: R-X + NaOH
R-OH + NaX
- Đun nhẹ hỗn hợp etyl bromua trong dung dịch NaOH, đồng thời lắc đều. Sau một thời gian thu được hỗn hợp đồng nhất, do đã xảy ra phản ứng:
CH3-CH2-Br + NaOH → C2H5OH + NaBr
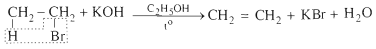
1.3.2. Phản ứng tách hidrohalogennua
- Đun sôi hỗn hợp gồm etyl bromua, kali hidroxit và etanol thấy có khí không màu thoát ra:
1.4. Ứng dụng
1.4.1. Làm nguyên liệu cho tổng hợp hữu cơ
- Vinylclorua tổng hợp nhựa PVC
Hình 1: Ống PVC và ống PVC màu
- Isopren tổng hợp cao su Isopren
- CF2=CF2 tổng hợp tefon
Hình 2: Dụng cụ nấu ăn chống dính
- Tổng hợp ancol, phenol…
1.4.2. Làm dung môi
- Clorofom ; 1,2- đicloetan…
1.4.3. Các lĩnh vực khác
- Thuốc trừ sâu, diệt côn trùng, thuốc gây mê
1.5. Tổng kết
Hình 3: Sơ đồ tư duy bài Dẫn xuất halogen
Bài 1:
Xét 6 nhận định sau:
(1) Phản ứng monobrom hóa propan (bằng Br2, đun nóng) tạo sản phẩm chính là propyl bromua.
(2) Phản ứng của isobutilen với hidro clorua tạo sản phẩm chính là t-butyl clorua.
(3) Phản ứng dehidrat hóa 2-metylpentan-3-ol tạo sản phẩm chính là 4-metylpent-2-en.
(4) Phản ứng của buta-1,3-đien với brom có thể tạo cả 3,4-đibrombut-1-en và 1,4-đibrombut-2-en.
(5) Điclo hóa benzen bằng Cl2 (xúc tác bột Fe, đun nóng) ưu tiên tạo sản phẩm là o-điclobenzen và p-điclobenzen.
(6) Monoclo hóa toluen bằng Cl2 (chiếu sáng) ưu tiên tạo sản phẩm là o-clotoluen và p-clotoluen.
Nhận định nào sai trong số sáu nhận định trên?
Hướng dẫn:
Các nhận định đúng: (2); (4); (5)
Các nhận định sai: (1), (3), (6)
(1) Sai. Sản phẩm chính phải là isopropyl bromua
(3) Sai. Sản phẩm chính là (CH3)2C=CH–CH2–CH3 (2-metylpent-2-en)
(6) Sai. Vì sản phẩm là C6H5CH2Cl (benzyl clorua)
Bài 2:
Xét sáu nhận định sau:
(1) Phản ứng monobrom hóa propan (bằng Br2, đun nóng) tạo sản phẩm chính là n-propyl bromua.
(2) Phản ứng của isobutilen với hidro clorua tạo sản phẩm chính là tert-butyl clorua.
(3) Phản ứng đehidrat hóa 2-metylpentan-3-ol tạo sản phẩm chính là 4-metylpent-2-en.
(4) Phản ứng của buta-1,3-đien với brom có thể tạo cả 3,4-đibrombut-1-en và 1,4-đibrombut-2-en.
(5) Điclo hóa benzen bằng Cl2 (xúc tác bột Fe, đun nóng) ưu tiên tạo sản phẩm là o-điclobenzen và p- điclobenzen.
(6) Monoclo hóa toluen bằng Cl2 (chiếu sáng) ưu tiên tạo sản phẩm là o-clotoluen và p-clotoluen.
Số nhận định sai trong số sáu nhận định này là? Giải thích vì sao?
Hướng dẫn:
(1) Phản ứng monobrom hóa propan (bằng Br2, đun nóng) tạo sản phẩm chính là n-propyl bromua.
⇒ Sai. Sản phẩm chính là iso- propyl bromua.
(2) Phản ứng của isobutilen với hidro clorua tạo sản phẩm chính là tert-butyl clorua.
⇒ Đúng.
(3) Phản ứng đehidrat hóa 2-metylpentan-3-ol tạo sản phẩm chính là 4-metylpent-2-en.
⇒ Sai. Sản phẩm chính là 2-metylpent-2-en.
(4) Phản ứng của buta-1,3-đien với brom có thể tạo cả 3,4-đibrombut-1-en và 1,4-đibrombut-2-en.
⇒ Đúng.
(5) Điclo hóa benzen bằng Cl2 (xúc tác bột Fe, đun nóng) ưu tiên tạo sản phẩm là o-điclobenzen và p- điclobenzen.
⇒ Đúng.
(6) Monoclo hóa toluen bằng Cl2 (chiếu sáng) ưu tiên tạo sản phẩm là o-clotoluen và p-clotoluen.
⇒ Sai. Đây là phản ứng thế Clo vào nhóm -CH3.
Bài 3:
Đun 24,44 gam hỗn hợp anlyl clorua và etyl bromua với dung dịch NaOH dư, sau phản ứng hoàn toàn axit hóa bằng HNO3 rồi cho dung dịch AgNO3 dư vào thu được 43,54 gam kết tủa. Phần trăm khối lượng của anlyl clorua trong hỗn hợp là?
Hướng dẫn:
24,44 g hỗn hợp có x mol CH2=CH-CH2-Cl và y mol C2H5Br
Ta có sơ đồ: hh đầu → NaCl; NaBr → AgCl; AgBr
⇒ m kết tủa = 143,5x + 188y = 43,54
và m hh đầu = 76,5x + 109y = 24,44
⇒ x = 0,12 mol; y = 0,14 mol
⇒ %m C3H5Cl = 37,56%.
Lấy giá trị xấp xỉ là 38%
3. Luyện tập Bài 39 Hóa học 11
Sau bài học cần nắm:
- Khái niệm, phân loại dẫn xuất halogen
- Tính chất hóa học đặc trưng của một số dẫn xuất halogen
- Hoạt tính sinh học và ứng dụng của một số dẫn xuất halogen
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 39 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. C6H5Cl.
- B. CH3CH2CH2Cl.
- C. CH2=CHCH2Cl.
- D. C6H5CH2Cl.
-
- A. 1-etyl-3-metylbenzen.
- B. 1,3,5-trimetylbenzen.
- C. Propylbenzen.
- D. Cumen.
-
- A. ClCH2COOCH2CH3.
- B. CH3COOCH2CH2Cl.
- C. CH3COOCH(Cl)CH3.
- D. HCOOCH(Cl)CH2CH3.
-
- A. 4.
- B. 3.
- C. 2.
- D. 1.
-
- A. iso-butyl clorua.
- B. sec-butyl clorua.
- C. tert-butyl clorua.
- D. n- butyl clorua.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 39.
Bài tập 39.3 trang 61 SBT Hóa học 11
Bài tập 39.4 trang 61 SBT Hóa học 11
Bài tập 39.5 trang 61 SBT Hóa học 11
Bài tập 39.6 trang 61 SBT Hóa học 11
Bài tập 1 trang 215 SGK Hóa học 11 nâng cao
Bài tập 2 trang 215 SGK Hóa học 11 nâng cao
Bài tập 3 trang 215 SGK Hóa học 11 nâng cao
Bài tập 4 trang 216 SGK Hóa học 11 nâng cao
Bài tập 5 trang 216 SGK Hóa học 11 nâng cao
Bài tập 6 trang 216 SGK Hóa học 11 nâng cao
Bài tập 7 trang 216 SGK Hóa học 11 nâng cao
Bài tập 8 trang 216 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 39 Chương 8 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

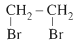

.PNG)
.PNG)