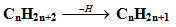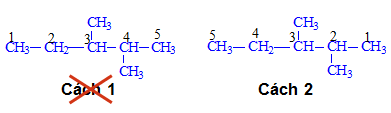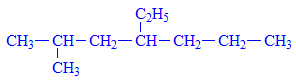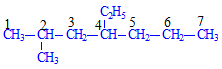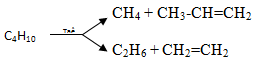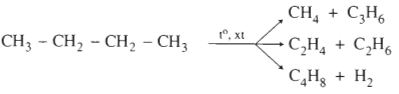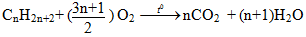Hoá học 11 Bài 25 Ankan
Tóm tắt bài
1.1. ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP CỦA ANKAN
1.1.1. Đồng đẳng
- Chất đầu tiên trong dãy ankan là metan: CH4, tiếp đến là C2H6, C3H8, C4H10....
- Công thức chung CnH2n+2 (\(n \ge 1\))
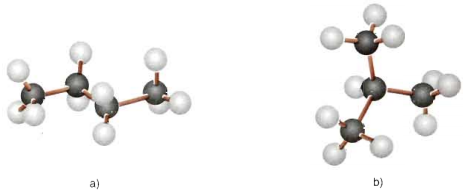
Hình 1: Mô hình phân tử
a) Butan b) Isobutan
- Nhận xét về phân tử C4H10:
- Chứa các liên kết đơn
- Mỗi nguyên tử C tạo được 4 liên kết đơn hướng về 4 đỉnh của 1 hình tứ diện đều
- Các nguyên tử C không nằm trên cùng 1 đường thẳng.
- Nhận xét chung về ankan:
- Trong phân tử ankan chỉ có liên kết C-C và C-H
- Mỗi nguyên tử Cacbon tạo được 4 liên kết đơn hướng từ nguyên tử C (nằm ở tâm hình tứ diện) về 4 đỉnh của hình tứ diện với góc liên kết \(\widehat {CCC},\widehat {HCH},\widehat {CCH}\) khoảng 109,5o
⇒ Các nguyên tử Cacbon trong phân tử ankan (trừ C2H6) không cùng nằm trên một đường thẳng.
1.1.2. Đồng phân
- Từ C4H10 trở đi có đồng phân cấu tạo (đồng phân mạch C).
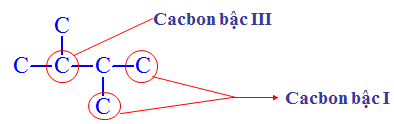
- Bậc C: Bậc của nguyên tử C ở phân tử ankan bằng số nguyên tử C liên kết trực tiếp với nó.
Hình 2: Bậc Cacbon
- Ankan chỉ chứa C bậc I và C bậc II là ankan không phân nhánh, chứa C bậc III và C bậc IV là ankan phân nhánh.
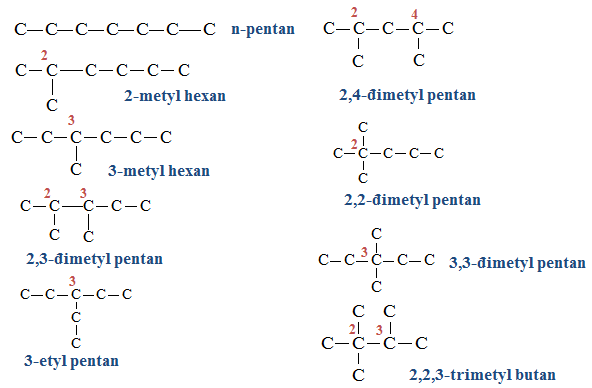
- Ví dụ 1: Viết đồng phân của C5H12
- Lưu ý: Nếu làm bài trắc nghiệm có thể đếm số đồng phân bằng cách:
- Vẽ ra sườn cacbon, bỏ qua bước điền -H vì điều đó làm hình rối. Sau đó dùng mũi tên đánh dấu các vị trí nhánh là ta đếm đủ số đồng phân. Nhớ chú ý đến tính đối xứng của phân tử để tránh trùng lặp công thức.
- Hoặc có thể sử dụng công thức tính số đồng phân của ankan là 2n-4 + 1 (với 3
- Ví dụ 2: Viết đồng phân của C6H14
Áp dụng công thức tính nhanh thì C6H14 có 2(6 - 4) + 1 = 5 đồng phân. thử kiểm tra lại bằng cách vẽ và đếm nhé!
1.1.3. Danh pháp
Tên hệ thống theo danh pháp IUPAC
|
Số nguyên tử cacbon |
Tên gọi mạch chính |
|
1 |
Met- |
|
2 |
Et- |
|
3 |
Prop- |
|
4 |
But- |
|
5 |
Pent- |
|
6 |
Hex- |
|
7 |
Hept- |
|
8 |
Oct- |
|
9 |
Non- |
|
10 |
Đec- |
Bảng 1: Quy tắc gọi tên mạch chính
a) Ankan không phân nhánh
- Tên ankan = tên C mạch chính + an
- Ví dụ: H3C-CH3 (etan); H3C-CH2-CH2-CH3 (Butan)
b) Ankan phân nhánh: Gọi theo kiểu tên thay thế.
- Tên ankan = Số chỉ vị trí nhánh + Tên nhánh + Tên mạch chính + an
-
Tên gốc ankyl: Đổi đuôi an thành yl
(ankan) (gốc ankyl)
Nhóm nguyên tử còn lại sau khi lấy bớt 1 nguyên tử H từ phân tử ankan, có công thức CnH2n+1, được gọi là nhóm ankyl. Tên của nhóm ankyl lấy từ tên của ankan tương ứng đổi đuôi an thành đuôi yl
- Một số quy tắc gọi tên:
- Mạch Cacbon chính là mạch C dài nhất.
- Đánh số thứ tự các nguyên tử Cacbon mạch chính từ phía gần nhánh hơn.
- Gọi tên nhánh theo thứ tự alphabe. Ví dụ: nhánh CH3- (metyl) với nhánh C2H5- (etyl) thì gọi tên nhánh etyl trước metyl vì chữ cái e đứng trước m trong thứ tự anphabe.
-
Nếu có nhiều nhánh giống nhau, ta thêm “đi” , “tri”, “tetra”, “penta”....
- Lưu ý: không lấy kí tự đầu của từ chỉ số lượng nhánh để xét thứ tự gọi tên.
Ví dụ: (CH3)2- : Đimetyl ; C2H5- :Etyl
Tuyệt đối không lấy kí tự Đ trong từ chỉ số lượng "đi" để xét. Trong trường hợp này, ta dùng chữ cái đầu của tên nhánh là m và e, như vậy vẫn là gọi tên nhánh etyl trước, metyl sau.
- Ví dụ 1: Gọi tên chất sau đây
Có 2 cách đánh số mạch chính như sau:
Cách 1: (Sai) vì hai nhánh có số là 3 và 4 thì sẽ lớn hơn Cách 2 (đúng) có số của hai nhánh là 2 và 3
Trong đó có chứa 2 nhánh CH3- (metyl) ta đọc tên là 2,3- Đimetylpentan
- Ví dụ 2: Gọi tên chất sau đây
Ta đánh số thứ tự trước
Trên đây có chứa 1 nhóm Etyl (C2H5-)và 1 nhóm mety (CH3-), vì chữ e đứng trước chữ m nên ta đọc nhánh etyl trước
Tên gọi: 4-etyl-2-metylheptan
1.2. TÍNH CHẤT VẬT LÍ CỦA ANKAN
1.2.1. Nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng
- Trạng thái: ở đk thường các ankan từ C1 → C4 ở trạng thái khí, từ C5 → C18 ở trạng thái lỏng, C19 trở đi ở trạng thái rắn.
- t0nc, t0s của ankan nói chung đều tăng theo số nguyên tử C trong phân tử tức là tăng theo phân tử khối.
- Khối lượng riêng tăng theo số nguyên tử C trong phân tử nhưng luôn nhỏ hơn khối lượng riêng của nước. (ankan nhẹ hơn nước)
1.2.2. Tính tan
- Không tan trong nước.
- Là những dung môi không phân cực.
- Hoà tan được vào những chất không phân cực. An kan lỏng có thể thấm qua da hoặc màng tế bào.
1.3. TÍNH CHẤT HÓA HỌC CỦA ANKAN
- Do chỉ có liên kết \(\sigma\) tương đối bền vững, trơ về mặt hoá học, ở điều kiện thường chúng không phản ứng được với axit, bazơ, các chất oxi hoá mạnh.
- Dưới tác dụng của nhiệt độ và ánh sáng ankan tham gia các phản ứng thế, phản ứng tách, phản ứng oxi hoá.
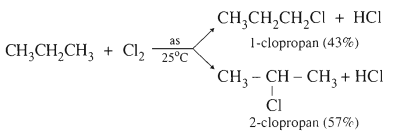
1.3.1. Phản ứng thế
CH4 + Cl2 → CH3Cl + HCl
clometan (metylclorua)
CH3Cl + Cl2 → CH2Cl2 + HCl
điclometan (metylenclorua)
CH2Cl2 + Cl2 → CHCl3 + HCl
triclometan (clorofom)
CHCl3 + Cl2 → CCl4 + HCl
tetraclometan (cacbontetra clorua)
- Nhận xét: Sản phẩm thế ưu tiên với H ở C bậc cao
1.3.2. Phản ứng tách
Gãy liên kết C-C, C-H; chất xúc tác thường dùng là Cr2O3, Fe, Pt.
a) Tách H2 (Đề hidro hóa)
CH3-CH3 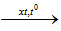
b) Phản ứng crackinh (bẻ gãy mạch cacbon)
1.3.3. Phản ứng Oxi hóa hoàn toàn
- Phương trình phản ứng tổng quát đốt cháy:
⇒ số mol H2O luôn luôn lớn hơn CO2
- Nếu thiếu Oxi, phản ứng cháy của ankan xảy ra không hoàn toàn, sản phẩm cháy ngoài CO2, H2O còn có CO, C ...
1.4. ĐIỀU CHẾ ANKAN
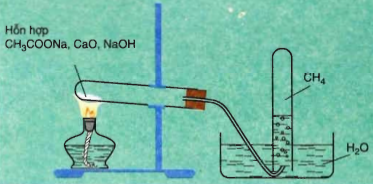
1.4.1. Phòng thí nghiệm
Làm thí nghiệm điều chế CH4 từ Natri axetat với vôi tôi xút.
CH3COONa+NaOH .PNG)
Al4C3+12H2O → 3CH4 + 4Al(OH)3
Hình 2: Điều chế Metan trong phòng thí nghiệm
Video: Điều chế Metan
1.4.2. Trong Công nghiệp
Metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ
Hình 3: Metan và các đồng đẳng được tách từ khí thiên nhiên và dầu mỏ
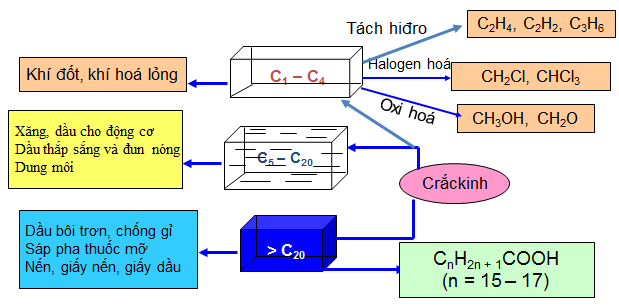
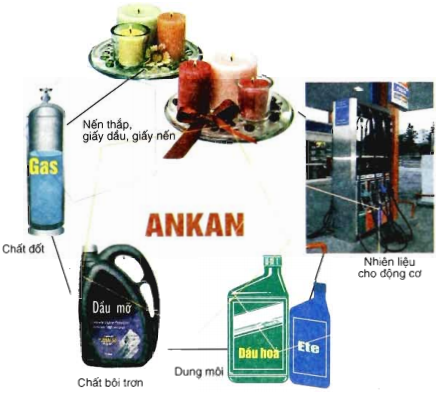
1.5. ỨNG DỤNG CỦA ANKAN
- Từ C1 đến C20 được ứng dụng làm nhiên liệu
- Nhiều Ankan được dùng làm dung môi và dầu bôi trơn máy.
- Điều chế chất sinh hàn.
- Nhờ tác dụng của nhiệt và các phản ứng oxy hoá không hoàn toàn → HCHO, rượu metylic , axitaxetic…v..v…
Hình 4: Ứng dụng của ankan
Bài 1:
Viết và gọi tên các đồng phân của C7H16
Hướng dẫn:
Áp dụng công thức tính nhanh số đồng phân có: 2(7-4) + 1 = 9 đồng phân
Bài 2:
Hỗn hợp khí X gồm C3H8 và H2. Cho thêm vào hỗn hợp X một lượng O2 vừa đủ để phản ứng rồi đưa vào tất cả các khí nhiên kế.Sau khi thực hiện phản ứng cháy và làm lạnh cho hơi nước ngưng tụ, thể tích khí sau khi phản ứng bằng 2,55 lần thể tích hỗn hợp X ban đầu. Phần trăm thể tích C3H8 trong hỗn hợp X là:
Hướng dẫn:
Phương trình hóa học:
\(C_{3}H_{8}\hspace{10pt}+5O_{2}\rightarrow 3CO_{2}\hspace{10pt}+4H_{2}O\)
\(a\hspace{50pt}5a\hspace{40pt}3a\)
\(2H_{2}+O_{2}\rightarrow H_{2}O\)
\(b\hspace{30pt}\frac{b}{2}\)
nKhí X = a + b ; nKhí sau phản ứng = 3a
Ta có : \(\frac{3a}{a+b}.100=2,55\Rightarrow \frac{a}{a+b}=0,85\)
\(\%C_{3}H_{8}=\frac{a}{a+b}.100=0,85.100=85\%\)
Bài 3:
Đốt cháy một lượng hỗn hợp X gồm etan và propan ta thu được CO2 và hơi H2O theo tỉ lệ thể tích 8:11. Thành phần % theo thể tích của etan trong X là:
Hướng dẫn:
\(\left\{\begin{matrix} C_{2}H_{6} \ (x) \\ C_{3}H_{8} \ (y) \end{matrix}\right. \rightarrow \left\{\begin{matrix} 2CO_{2} + 3H_{2}O \\ 3CO_{2} + 4H_{2}O \end{matrix}\right.\)
\(\left\{\begin{matrix} x + y = 1 \ \ \ \ \ \\ \dfrac{2x+3y}{3x+4y}=\dfrac{8}{11} \end{matrix}\right. \Rightarrow \left\{\begin{matrix} x = \dfrac{1}{3} \\ y = \dfrac{2}{3} \end{matrix}\right.\)
\(\Rightarrow \%V_{C_{2}H_{6}} = 33,33 \ \%\)
3. Luyện tập Bài 25 Hóa học 11
Sau bài học cần nắm:
- Lập dãy đồng đẳng , viết các đồng phân.
- Viết và xác định được các sản phẩm chính của phản ứng thế, gọi được tên các ankan cũng như các sản phẩm tạo ra trong các phản ứng đó.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 25 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 1,1-đimetylbutan
- B. 2-metylpentan
- C. Neopentan
- D. Isopentan
-
- A. 2,4,4-trimetylpentan
- B. 2,2,4-trimetylpentan
- C. 2,2,4-trimetylhexan
- D. isooctan
-
- A. Phản ứng thế
- B. Phản ứng cộng
- C. Phản ứng tách
- D. Không phải 3 loại trên
-
- A. C3H8 và C4H10.
- B. C2H4 và C3H6.
- C. C3H6 và C4H8.
- D. C3H4 và C4H6.
-
- A. 1,1,2 và 4
- B. 5,1,1 và 1
- C. 4,2,1 và 1
- D. 1,1,1 và 5
-
- A. Metan.
- B. Etan.
- C. Propan.
- D. Butan.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 25.
Bài tập 5 trang 139 SGK Hóa học 11 nâng cao
Bài tập 1 trang 142 SGK Hóa học 11 nâng cao
Bài tập 2 trang 142 SGK Hóa học 11 nâng cao
Bài tập 3 trang 142 SGK Hóa học 11 nâng cao
Bài tập 4 trang 143 SGK Hóa học 11 nâng cao
Bài tập 5 trang 143 SGK Hóa học 11 nâng cao
Bài tập 1 trang 147 SGK Hóa học 11 nâng cao
Bài tập 2 trang 147 SGK Hóa học 11 nâng cao
Bài tập 3 trang 147 SGK Hóa học 11 nâng cao
Bài tập 4 trang 147 SGK Hóa học 11 nâng cao
Bài tập 5 trang 147 SGK Hóa học 11 nâng cao
Bài tập 6 trang 147 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 25 Chương 5 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK