Hoá học 11 Bài 20: Mở đầu về hóa học hữu cơ
Tóm tắt bài
1.1. Khái niệm về hợp chất hữu cơ và hoá học hữu cơ
- Hợp chất hữu cơ là hợp chất của cacbon (trừ các oxít của cacbon, muối cacbonat, xianua và các bua…)
- Hoá học hữu cơ là ngành hoá học nghiên cứu các hợp chất hữu cơ.
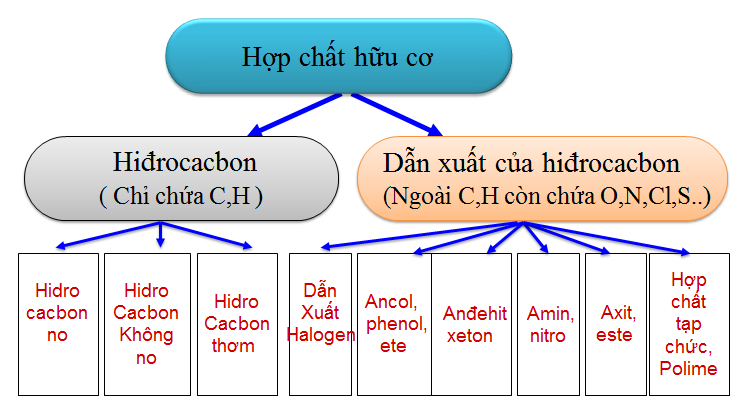
1.2. Phân loại hợp chất hữu cơ
1.2.1. Dựa vào thành phần các nguyên tố
Hình 1: Phân loại hợp chất hữu cơ
1.2.2. Theo mạch cacbon
Hình 2: Phân loại dựa vào mạch cacbon
1.3. Đặt điểm chung của hợp chất hữu cơ
1.3.1. Đặc điểm cấu tạo
- Nguyên tố bắt buộc có là cacbon
- Thường gặp H, O, N, S , P , Hal . . .
- Liên kết hóa học chủ yếu trong chất hữu cơ là liên kết cộng hóa trị.
1.3.2. Tính chất vật lý
- Các hợp chất hữu cơ thường dễ bay hơi (tonc, to bay hơi thấp )
- Kém bền đối với nhiệt và dễ cháy
- Không tan hoặc ít tan trong nước, tan trong dung môi hữu cơ
1.3.3. Tính chất hóa học
- Kém bền với nhiệt, dễ bị phân hủy.
- Các phản ứng của hợp chất hữu cơ thường chậm và không hoàn toàn theo một hướng nhất định→ Thu được hỗn hợp sản phẩm
1.4. Sơ lượt về phân tích nguyên tố
1.4.1. Phân tích định tính
Mục đích
Xác định các nguyên tố có trong hợp chất hữu cơ.
Nguyên tắc
Chuyển hợp chất hữu cơ thành các chất vơ cơ đơn giản, rồi nhận biết bằng phản ứng đặc trưng.
Phương pháp tiến hành
Hình 3: Phương pháp tiến hành phân tích định tính hợp chất hữu cơ
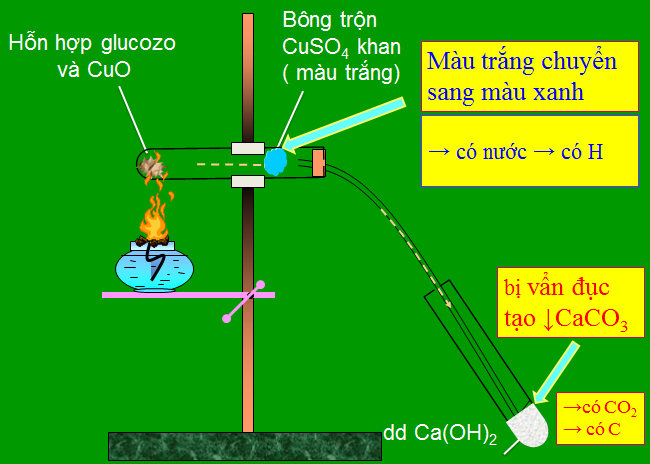
Hình 4: Thí nghiệm xác định nguyên tố Cacbon, Hidro có trong Glucozơ
1.4.2. Phân tích định lượng
Mục đích
Xác định thành phần phần trăm về khối lượng các nguyên tố có trong hợp chất hữu cơ.
Nguyên tắc
- Cân một lượng chính xác hợp chất hữu cơ
- Chuyển nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản như CO2 , H2O , N2…
- Xác định m hoặc V của CO2, H2O, N2… Từ đó tính m và %m của các nguyên tố trong hợp chất hữu cơ.
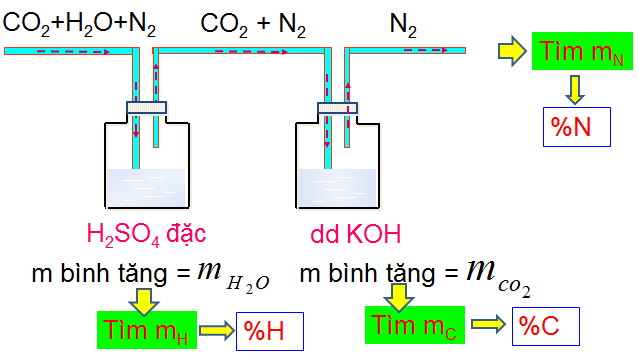
Hình 5: Phương pháp tiến hành phân tích định lượng
Biểu thức tính
\(\begin{array}{l} {m_C} = \frac{{{m_{C{O_2}}}}}{{44}}.12 \Rightarrow \% C = \frac{{{m_C}}}{a}.100\% \\ {m_H} = 2.\frac{{{m_{{H_2}O}}}}{{18}} \Rightarrow \% H = \frac{{{m_H}}}{a}.100\% \\ {m_N} = 2.\frac{{{V_{{N_2}}}}}{{22,4}}.14 \Rightarrow \% N = \frac{{{m_N}}}{a}.100\% \\ \% O = 100\% - (\% C + \% H + \% N + ...) \end{array}\)
Bài 1:
Cho các chất sau: C3H8, CH3Cl, NaNO3, K2CO3.
CH3COONa , C6H6, Hãy phân loại chúng bằng cách đánh dấu X vào cột tương ứng.
Hướng dẫn:
| Hợp chất | Hợp chất hữu cơ | Hợp chất vô cơ | |
| Hidrocacbon | Dẫn xuất hidrocabon | ||
|
C3H8 |
X | ||
|
CH3Cl |
X | ||
|
NaNO3 |
X | ||
|
K2CO3 |
X | ||
|
CH3COONa |
X | ||
|
C6H6 |
X | ||
Bài 2:
Phân tích 0,29 gam một hợp chất hữu cơ chỉ chứa C, H, O ta có %C = 62,06%; %H = 10,34%. Vậy khối lượng oxi trong hợp chất là:
Hướng dẫn:
\(\begin{array}{l} \% {m_O} = 100\% - \% {m_H} - \% {m_C} = 100 - 10,34 - 62,06 = 27,6\\ \Rightarrow {m_o} = 27,6\% .0,29 = 0,08{\rm{ }}gam \end{array}\)
Bài 3:
Cho thí nghiệm như hình vẽ:
Hãy cho biết thí nghiệm này dùng để phân tích định tính nguyên tố nào trong hợp chất hữu cơ?
Hướng dẫn:
Dùng CuSO4 khan để nhận ra H2O (chuyển màu từ trắng thành xanh) ⇒ Xác định trong thành phần hợp chất hữu cơ có chứa nguyên tố H.
Dùng Ca(OH)2 dư để nhận ra CO2 do tạo kết tủa vẩn đục ⇒ Xác định trong thành phần hợp chất hữu cơ có chứa nguyên tố C.
3. Luyện tập Bài 20 Hóa học 11
Sau bài học cần nắm:
- Khái niệm hoá học hữu cơ và hợp chất hữu cơ, đặc điểm chung của các hợp chất hữu cơ
- Phân loại hợp chất hữu cơ theo thành phần nguyên tố (hiđrocacbon và dẫn xuất)
- Các loại công thức của hợp chất hữu cơ: Công thức chung, công thức đơn giản nhất, công thức phân tử và công thức cấu tạo
- Sơ lược về phân tích nguyên tố: Phân tích định tính, phân tích định lượng
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 20 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Nhất thiết phải chứa Cacbon
- B. Liên kết trong các hợp chất hữu cơ thường là liên kết cộng hóa trị.
- C. Phản ứng của các hợp chất hữu cơ thường xảy ra hoàn toàn theo một hướng nhất định.
- D. Không tan hoặc ít tan trong nước.
-
Câu 2:
Đốt cháy hoàn toàn hợp chất hữu cơ Y thu được CO2, H2O, HCl. Trong phân tử Y chứa nguyên tố nào:
- A. Cacbon, hiđro, oxi và clo
- B. Cacbon, hiđro và clo
- C. Cacbon, hiđro, clo và có thể có oxi
- D. Cacbon, hiđro, oxi và có thể có clo
-
- A. Tìm công thức phân tử của hợp chất hữu cơ
- B. Tìm công thức đơn giản nhất của chất hữu cơ
- C. Xác định phân tử khối của chất hữu cơ
- D. Xác định các nguyên tố trong phân tử chất hữu cơ
-
- A. CuCl2 khan, dung dịch Ca(OH)2
- B. Dung dịch Ca(OH)2, CuSO4 khan
- C. Dung dịch Ca(OH)2, dung dịch CuSO4
- D. Ca(OH)2 khan, CuCl2 khan
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 20.
Bài tập 20.2 trang 28 SBT Hóa học 11
Bài tập 20.3 trang 28 SBT Hóa học 11
Bài tập 20.4 trang 28 SBT Hóa học 11
Bài tập 20.5 trang 29 SBT Hóa học 11
Bài tập 20.6 trang 29 SBT Hóa học 11
Bài tập 20.7 trang 29 SBT Hóa học 11
Bài tập 20.8 trang 29 SBT Hóa học 11
Bài tập 1 trang 104 SGK Hóa học 11 nâng cao
Bài tập 2 trang 104 SGK Hóa học 11 nâng cao
Bài tập 3 trang 104 SGK Hóa học 11 nâng cao
Bài tập 4 trang 104 SGK Hóa học 11 nâng cao
Bài tập 5 trang 104 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 20 Chương 4 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK

.PNG)
.PNG)
.PNG)