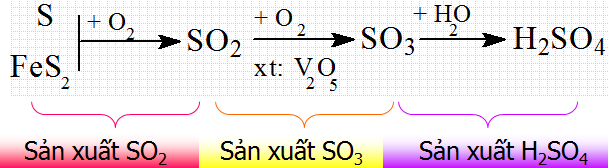Hoá học 10 Bài 33: Axit sunfuric - Muối sunfat
Tóm tắt bài
Video 1: Giới thiệu về axitsunfuric
1.1. Axit sunfuric
1.1.1. Tính chất vật lí
- Chất lỏng, sánh như dầu, không màu, không bay hơi.
- Tan vô hạn trong nước và tỏa nhiều nhiệt.
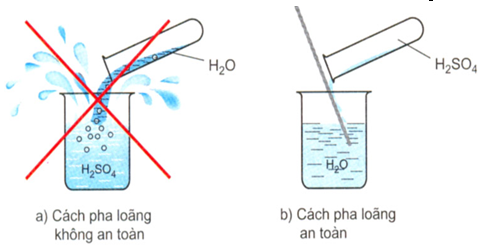
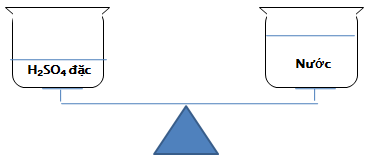
- Cách pha loãng axit sunfuric đặc: Rót từ từ axit đặc vào nước dọc theo đũa thủy tinh và khuấy đều. Tuyệt đối không làm ngược lại.
Hình 1: Cách pha loãng axit sunfuric
- H2SO4 đặc khi tan vào nước sẽ tạo ra một lượng nhiệt rất lớn. Nếu đổ ngược lại sẽ làm nước sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Nếu bắn vào quần áo sẽ làm cháy quần áo, bắn vào da sẽ gây bỏng axit.
1.1.2. Tính chất hoá học
Tính chất của dung dịch axit sunfuric loãng
- Quỳ tím hoá đỏ
- Tác dụng với kim loại đứng trước Hà muối + H2
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với bazơ và oxit bazơ → Muối + nước
Na2O + H2SO4 → Na2SO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
- Tác dụng với muối của axit yếu hơn
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Tính chất của axit sunfuric đặc
Tính oxi hoá mạnh
a. Tác dụng với kim loại
- H2SO4 đặc, nóng oxi hoá được hầu hết các kim loại (trừ Au, Pt)
M + H2SO4 → M2(SO4)n + {SO2, S, H2S } + H2O
(n là hóa trị cao nhất của kim loại)
-
Ví dụ:
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
6H2SO4đ,n+2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Video 2: Thí nghiệm so sánh Cu khi phản ứng với H2SO4 đặc và loãng
- Chú ý: Al,Cr, Fe thụ động hóa trong H2SO4 đặc nguội.
Thụ động hóa nghĩa là kim loại sau khi nhúng vào dung dịch H2SO4 đặc nguội, lấy ra thì không còn khả năng phản ứng với axit loãng , dung dịch muối mà bình thường nó có phản ứng.
b. Tác dụng với phi kim có tính khử
- H2SO4 đặc, nóng tác dụng được với các phi kim có tính khử tạo hợp chất của phi kim có số oxi hóa cao nhất (trừ S) như C,P, …
2H2SO4 + C → CO2 + 2SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
Video 3: Phản ứng giữa bột lưu huỳnh và axit sunfuric đặc
c. Tác dụng với hợp chất
- H2SO4 đặc, nóng còn tác dụng được với các hợp chất có tính khử như H2S, FeO, KBr, HI, …
3H2SO4 + H2S → 4SO2 + 4H2O
2H2SO4 + KBr → Br2 + SO2 + 2H2O + K2SO4
Tính háo nước
- H2SO4đặc lấy nước từ các hợp chất hữu cơ làm hoá than các hợp chất gluxit ví dụ glucozơ, saccarozơ, tinh bột và xenlulozơ.
Cn(H2O)m 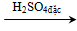
(gluxit)
- Phản ứng của axit sunfuric với đường:
Video 4: Axit sunfuric tác dụng với đường
Phương trình: C12H22O11 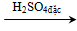
Một phần Cacbon bị H2SO4 đặc oxi hóa thành khí CO2 cùng SO2 bay lên làm sủi bọt, đẩy Cacbon trào ra ngoài cốc.
C + 2H2SO4 → 2CO2 + SO2 + 2H2O
- GV có thể làm thí nghiệm dùng đũa thuỷ tinh chấm H2SO4 đặc viết lên tờ giấy (nét chữ sẽ hoá đen) hoặc viết bằng dung dịch H2SO4 loãng rồi hơ tờ giấy lên ngọn lửa đèn cồn cho học sinh quan sát.
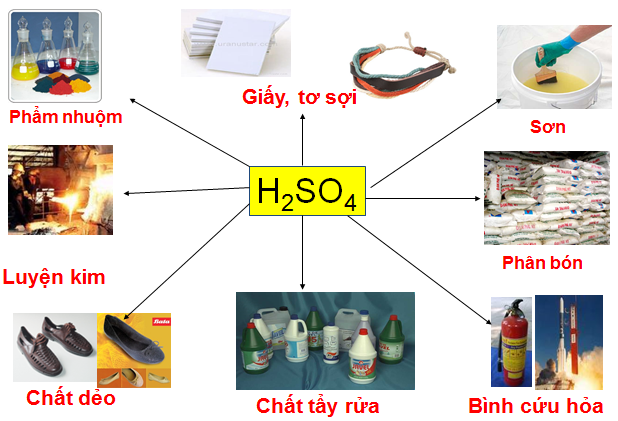
1.1.3. Ứng dụng
Hình 2: Ứng dụng của axit sunfuric
1.1.4. Sản xuất axit sunfuric
- Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc.
- Phương pháp gồm 3 công đoạn chính.
Hình 3: Công đoạn sản xuất axit sunfuric
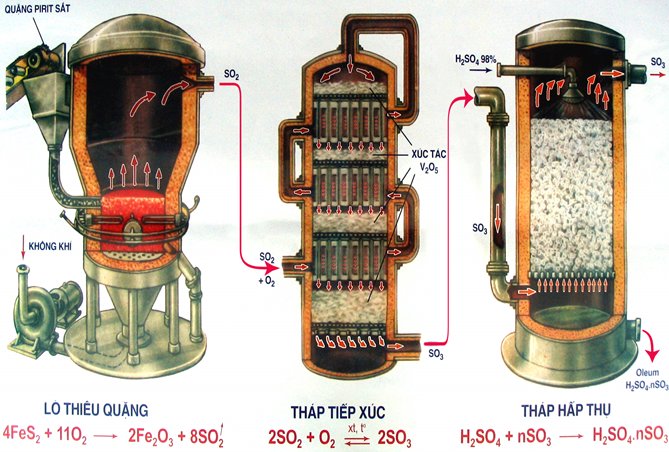
Sản xuất SO2
- Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2...
- Đốt cháy lưu huỳnh: S + O2
SO2
- Đốt quặng pirit sắt: 4FeS2 + 11O2
2SO2 + 8Fe2O3
Sản xuất SO3
Oxi hóa SO2 bằng khí Oxi hoặc không khí dư ở nhiệt độ 450 - 500oC, chất xúc tác là V2O5 (vanadi pentoxit)
SO2 + O2 .PNG)
Hấp thụ SO3 bằng H2SO4
-
Người ta hấp thụ SO3 bằng phương pháp ngược dòng. Trong tháp hấp thụ, cho khí SO3 đi từ dưới lên, H2SO4 tưới từ trên xuống để tạo được diện tích tiếp xúc tối đa, hiệu suất hấp thụ đạt cao nhất.
-
Chú ý: không dùng H2O để hấp thụ SO3 vì phản ứng xảy ra rất mãnh liệt, H2SO4 thu được ở dạng hơi nên rất khó vận chuyển.
nSO3 + H2SO4 → H2SO4.n SO3
oleum
H2SO4.n SO3 + nH2O → (n+1) H2SO4
Hình 4: Sơ đồ sản xuất axit sunfuric
1.2. Muối sunfat. Nhận biết muối sunfat
1.2.1. Muối sunfat
- Muối trung hòa chứa gốc SO42-: Na2SO4, CaSO4, … ( hầu hết đều tan trừ BaSO4, SrSO4, PbSO4 không tan và CaSO4, Ag2SO4 ít tan.
- Muối axit chứa gốc HSO4-: NaHSO4, Ca(HSO4)2, … (các muối axit đều tan)
1.2.2. Nhận biết muối sunfat
- Thuốc thử: dd muối của kim loại Ba, dd Ba(OH)2.
- Hiện tượng: có kết tủa trắng, không tan trong axit BaSO4
- Ví dụ: Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
Video 5: Nhận biết muối sunfat
Bài 1:
Trên một đĩa cân, đặt một cốc đựng H2SO4 đặc và trên đĩa cân còn lại đặt một cốc nước sao cho cân ở vị trí cân bằng. Hỏi sau một thời gian cân còn ở vị trí cân bằng hay không? Vì sao?
Hướng dẫn:
H2SO4 đặc có khả năng hút nước từ không khí nên làm cho cốc axit nặng hơn, cân lệch khỏi vị trí cân bằng.
Bài 2:
Hòa tan hỗn hợp gồm Al, Fe và Cu bằng dung dịch H2SO4 loãng thu được dung dịch X, Cho dung dịch X tác dụng với dung dịch NaOH dư thu được kết tủa Y. Nung kết tủa Y trong không khí đến khối lượng không đổi thu được chất rắn.
Hướng dẫn:
Hòa tan bằng H2SO4 ⇒ Cu không tác dụng.
Cho tác dụng NaOH dư chỉ còn lại kết tủa của Fe.
Nung hidoxit của Fe trong không khí ⇒ thu được Fe2O3.
Bài 3:
Một dung dịch chứa a mol H2SO4 hòa tan hết b mol Fe thu được khí A và 42,8 g muối khan. Cho a : b = 6 : 2,5. Giá trị của a, b lần lượt là:
Hướng dẫn:
Bảo toàn khối lượng: Giả sử tạo x mol Fe3+ và y mol Fe2+
⇒ x + y = b
Bảo toàn e: \(n_e = 3x+2y=2n_{SO_2};\ n_{SO_4\ muoi} = \frac{1}{2}(3n_{{Fe}^{2+}} + 2n_{{Fe}^{2+}}) = n_{SO_2}\)
\(\Rightarrow n_{H_2SO_4} = n_{SO_2} + n_{SO_4\ muoi} = 3x + 2y = a \Rightarrow n_{SO_4 \ muoi} = 0,5a\)
⇒ bảo toàn khối lượng: \(m_{Fe} + m_{SO_4\ muoi} = 42,8 = 56b + 96 \times 0,5a\)
Lại có: a : b = 6 : 2,5
⇒ a = 0,6; b = 0,25
Bài 4:
Một loại oleum có công thức H2SO4.nSO3. Lấy 33,8 g oleum nói trên pha thành 100ml dung dịch A. Để trung hoà 25 ml dung dịch A cần dùng vừa đủ 100ml dung dịch NaOH 2M. Giá trị của n là:
Hướng dẫn:
\(n_{H_2SO_4}=\frac{1}{2} n_{NaOH} = 0,1 \Rightarrow n_{H_2SO_4}\) tạo thành = 0,4
\(H_2SO_4.nSO_3+nH_2O \rightarrow (n+1)H_2SO_4\)
\(\Rightarrow n_{oleum} = \frac{0,4}{(n+1)} \Rightarrow 98+80n = \frac{33,8(n+1)}{0,4} \Rightarrow n=3\)
3. Luyện tập Bài 33 Hóa học 10
Sau bài học cần nắm:
- Tính chất vật lí của H2SO4. Cách pha loãng axit H2SO4 đặc.
- Dung dịch H2SO4 loãng có đầy đủ tính chất của một axit. Axit H2SO4 đặc có tính oxi hóa mạnh.
- H2SO4 loãng là axit mạnh (đổi màu chất chỉ thị, tác dụng với kim loại, bazơ, oxit bazơ và muối của axit yếu hơn…).
- H2SO4 đặc, nóng có tính oxi hoá mạnh gây ra bởi gốc SO42- trong đó S có số oxi hóa cao nhất +6.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Axit sunfuric - Muối sunfat có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. HCl
- B. Cl2
- C. H2SO4
- D. SO2
-
Câu 2:
Để pha loãng dung dịch H2SO4 đặc trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
- A. Cho từ từ nước vào axit và khuấy đều
- B. Cho từ từ axit vào nước và khuấy đều
- C. Cho nhanh nước vào axit và khuấy đều
- D. Cho nhanh axit vào nước và khuấy đều
-
- A. H2O
- B. dung dịch H2SO4 loãng
- C. H2SO4 đặc để tạo oleum
- D. H2O2
-
- A. Zn, Al,Au
- B. Zn, Fe ,Mg
- C. Cr,Al, Fe
- D. Al, Mg ,Fe
-
- A. 2Fe + 3H2SO4 loãng → Fe2(SO4)3 + 3H2↑
- B. 2Fe + 6H2SO4 loãng → Fe2(SO4)3 + 3SO2↑ + 6H2O
- C. 2Fe + 6H2SO4 đặc, nóng → Fe2(SO4)3 + 3SO2↑ + 6H2O
- D. 2Fe + 6H2SO4 đặc, nguội → Fe2(SO4)3 + 3SO2↑ + 6H2O
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Axit sunfuric - Muối sunfat.
Bài tập 7 trang 187 SGK Hóa học 10 nâng cao
Bài tập 33.14 trang 75 SBT Hóa học 10
Bài tập 8 trang 187 SGK Hóa học 10 nâng cao
Bài tập 33.15 trang 75 SBT Hóa học 10
Bài tập 9 trang 187 SGK Hóa học 10 nâng cao
Bài tập 33.16 trang 75 SBT Hóa học 10
Bài tập 10 trang 187 SGK Hóa học 10 nâng cao
Bài tập 33.17 trang 76 SBT Hóa học 10
Bài tập 33.18 trang 76 SBT Hóa học 10
Bài tập 33.19 trang 76 SBT Hóa học 10
Bài tập 33.20 trang 76 SBT Hóa học 10
Bài tập 33.21 trang 76 SBT Hóa học 10
4. Hỏi đáp về Bài 33 Chương 6 Hóa học 10
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK