Giải Hóa 10 Bài 13: Liên kết Hydrogen và tương tác Van der Waals là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách Kết nối tri thức với cuộc sống trang 64→67 thuộc Chương 3 Hóa 10.
Hóa 10 Bài 13 trang 64→67 sách Kết nối tri thức được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 trang 64→67 sách Kết nối tri thức, mời các bạn cùng theo dõi tại đây.
Giải Hóa 10: Liên kết Hydrogen và tương tác Van der Waals
I. Mở đầu
Mở đầu trang 64
Ở áp suất khí quyển, nhiệt độ sôi của H2O là 100oC, CH4 là -161,58oC, H2S là -60,28oC. ....
II. Liên kết hydrogen
Câu 1 trang 66
Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF).
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Gợi ý đáp án
a) H – F … H – F.
b)
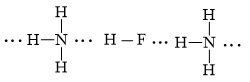
Câu 2 trang 66
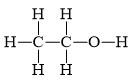
Những nguyên tử hydrogen nào trong phân tử ethanol (CH3CH2OH) không tham gia vào liên kết hydrogen? Vì sao?
Gợi ý đáp án
Những nguyên tử H không gắn nguyên tử O thì không tham gia vào liên kết hydrogen.
Vì để tham gia vào liên kết hydrogen, nguyên tử hydrogen phải liên kết với các nguyên tử có độ âm điện lớn như F, O, N, … và các nguyên tử tử này phải có ít nhất 1 cặp electron hóa trị chưa tham gia liên kết.
⇒ Chỉ có nguyên tử H gắn vào O trong ethanol tham gia vào liên kết hydrogen.
III. Tương tác Van der Waals
Câu 3 trang 67
Hãy giải thích sự khác nhau về nhiệt độ của butane và isobutane.
Gợi ý đáp án
Để phá vỡ lực liên phân tử giữa các phân tử butane cần nhiều năng lượng hơn so với isobutane nên nhiệt độ sôi của butane cao hơn.
Butane và isobutane là hợp chất cộng hóa trị không phân cực và có cùng công thức phân tử là C4H10. Đồng phân butane có nhiệt độ sôi cao hơn isobutane vì diện tích tiếp xúc của các phân tử butane lớn hơn so isobutane.
