Giải KHTN 7 Bài 7: Hóa trị và công thức hóa học giúp các em học sinh lớp 7 tham khảo để trả lời câu hỏi mở đầu, các hoạt động trong sách Khoa học tự nhiên 7 Kết nối tri thức với cuộc sống trang 40, 41, 42, 43, 44.
Qua đó, còn giúp các em viết được công thức hóa học của một số đơn chất và hợp chất đơn giản, thông dụng. Đồng thời, cũng giúp thầy cô soạn giáo án Bài 7 Chương II: Phân tử, Liên kết hóa học. Chi tiết mời thầy cô và các em cùng tham khảo bài viết dưới đây của Download.vn:
Giải KHTN Lớp 7 Bài 7: Hóa trị và công thức hóa học
Phần Mở đầu
Trong phân tử nước, một nguyên tử O liên kết với hai nguyên tử H, người ta nói rằng O có hóa trị II. Vậy hóa trị có mối liên hệ với công thức hóa học của hợp chất như thế nào?
Trả lời:
Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia
I. Công thức hóa học
Copper sulfate (CuSO4) được dùng làm chất chống xoăn lá cho cây cà chua. Em hãy cho biết số nguyên tử của từng nguyên tố có trong một phân tử copper sulfate và xác định phần trăm khối lượng của các nguyên tố trong hợp chất này.
Trả lời:
Trong một phân tử copper sulfate (CuSO4) có một nguyên tử Cu, một nguyên tử S và bốn nguyên tử O.
Khối lượng phân tử CuSO4 bằng: 64.1 + 32.1 + 16.4 = 160 (amu)
Phần trăm khối lượng các nguyên tố trong CuSO4 là:
![]()
![]()
%O = 100% - 40% - 20% = 40%
II. Hóa trị
1. Khái niệm hóa trị
Sơ đồ sau mô tả sự hình thành liên kết cộng hóa trị trong phân tử HCl:
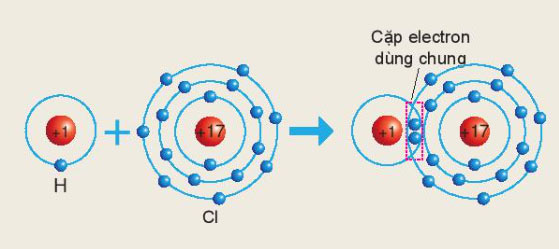
Xác định hóa trị của chlorine trong hợp chất trên.
Trả lời:
Hydrogen và chlorine bỏ ra 1 electron
=> Một cặp electron dùng chung
=> Chlorine có hóa trị I trong hợp chất HCl
2. Quy tắc hóa trị
Hoạt động: Tìm hiểu về quy tắc hóa trị
Quan sát Bảng 7.1 và thực hiện các yêu cầu sau:
Bảng 7.1.
Hóa trị của lưu huỳnh/carbon | Tích của chỉ số và hóa trị của lưu huỳnh/carbon | Tích của chỉ số và hóa trị của hydrogen | |
H2S | II | 1.II | 2.I |
CH4 | IV | 1.IV | 4.I |
1. Xét phân tử H2S, hãy so sánh tích của chỉ số và hóa trị của nguyên tố lưu huỳnh với tích của chỉ số và hóa trị của nguyên tố hydrogen.
2. Đối với phân tử CH4, thực hiện tương tự như phân tử H2S. Em hãy so sánh về tích của chỉ số và hóa trị của các nguyên tố thành phần.
Trả lời:
1. Xét phân tử H2S
Ta thấy: 1 × II = 2 × I
⇒ Tích của chỉ số và hóa trị của nguyên tố lưu huỳnh bằng tích của chỉ số và hóa trị của nguyên tố hydrogen.
2. Xét phân tử CH4.
Ta thấy: 1× IV = 4 × I
⇒ Tích của chỉ số và hóa trị của nguyên tố carbon bằng tích của chỉ số và hóa trị của nguyên tố hydrogen.
Câu 1. Xác định hóa trị của lưu huỳnh trong hợp chất sulfur dioxide (một nguyên tử S liên kết với hai nguyên tử O)
Trả lời:
Trong phân tử sulfur dioxide, một nguyên tử S liên kết với hai nguyên tử O nên S có hóa trị IV.
Câu 2. Hãy xác định hóa trị của carbon trong hợp chất methane có trong hình 5.3b
Trả lời:
Trong hợp chất methane, C liên kết với 4 nguyên tử H nên C có hóa trị IV
Câu 3. Dựa vào quy tắc hóa trị và Bảng 7.2, cho biết công thức hóa học của potassium oxide là KO hay K2O
Trả lời:
Từ bảng 7.2 cho biết K có hóa trị I, O có hóa trị II
Giả sử, công thức hóa học của potassium oxide là KO.
Nhận thấy: I × 1 ≠ II × 1
⇒ Giả sử sai.
⇒ Công thức hóa học của potassium oxide là K2O (vì I × 2 = II × 1)
III. Lập công thức hóa học của hợp chất
Câu 1. Khí carbon dioxide luôn có thành phần như sau: cứ 1 phần khối lượng carbon có tương ứng 2,667 phần khối lượng oxygen. Hãy lập công thức hóa học của khí carbon dioxide, biết khối lượng phân tử của nó là 44 amu.
Trả lời:
Bước 1: Gọi công thức của khí carbon dioxide là CxOy.
Bước 2: Khối lượng phân tử của khí carbon dioxide là: 12x + 16y = 44. (1)
Bước 3: Lập biểu thức tỉ lệ khối lượng C và O tính để tìm x, y
Ta có:
![]() (2)
(2)
Thế y = 2x vào (1) ta được: 12x + 16.2x = 44
Giải ra được: x = 1 ⇒ y = 2
Vậy công thức của khí carbon dioxide là CO2.
Câu 2. Hãy mô tả sự hình thành liên kết cộng hoá trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)
Trả lời:
Gọi công thức hóa học khí hydeogen sulfide là ![]()
Theo quy tắc hóa trị ta có: x . I = y . II
Chuyển biểu thức này thành tỉ lệ: ![]()
Thường tỉ lệ số nguyên tử trong phân tử là những số nguyên đơn giản nhất:
Vì vậy chọn x = 2, y = 1
Công thức khí hydrogen sulfide là H2S
Khối lượng phân tử H2S là: 2.1 + 32 = 34
![]()
% S = 100 % - 5,9 % = 94,1 %
