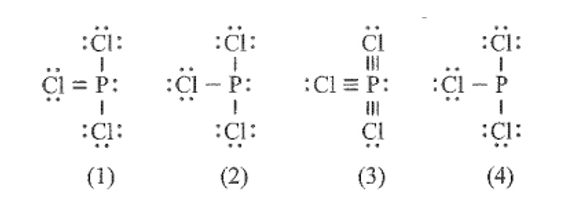Giải SBT Hóa 10 Bài 11: Liên kết cộng hóa trị có đáp án !!
Câu hỏi 1 :
Trong nguyên tử C, những electron có khả năng tham gia hình thành liên kết cộng hoá trị thuộc phân lớp nào sau đây?
A. 1s.
Câu hỏi 3 :
Liên kết cộng hoá trị thường được hình thành giữa
Liên kết cộng hoá trị thường được hình thành giữa
A. các nguyên tử nguyên tố kim loại với nhau.
Câu hỏi 4 :
Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là:
Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là:
A. 1, 2, 3, 4.
Câu hỏi 5 :
Trong phân tử HF, số cặp electron dùng chung và cặp electron hoá trị riêng của nguyên tử F lần lượt là:
Trong phân tử HF, số cặp electron dùng chung và cặp electron hoá trị riêng của nguyên tử F lần lượt là:
A. 1 và 3.
Câu hỏi 6 :
Cho công thức Lewis của các phân tử sau:
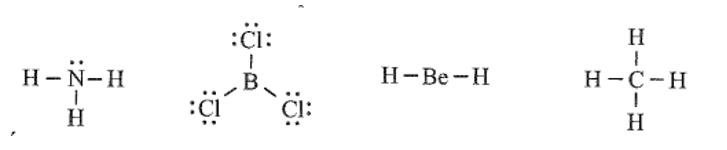
Số phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là
Cho công thức Lewis của các phân tử sau:
Số phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là
A. 1
B. 2
C. 3
D. 4
Câu hỏi 8 :
Dựa vào hiệu độ âm điện giữa hai nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất.
Dựa vào hiệu độ âm điện giữa hai nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất.
A. HF.
Câu hỏi 10 :
Khi tham gia hình thành liên kết trong các phân tử HF, F2; orbital tham gia xen phủ tạo liên kết của nguyên tử F thuộc về phân lớp nào, có hình dạng gì?
A. Phân lớp 2s, hình cầu.
Câu hỏi 12 :
Số orbital của cả hai nguyên tử N tham gia xen phủ tạo liên kết trong phân tử N2 là
Số orbital của cả hai nguyên tử N tham gia xen phủ tạo liên kết trong phân tử N2 là
A. 3
B. 4
C. 5
D. 6
Câu hỏi 13 :
Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các orbital cùng loại (ví dụ cùng là orbital s, hoặc cùng là orbital p)?
A. Cl2.
Câu hỏi 14 :
Phát biểu nào sau đây không đúng?
Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
Câu hỏi 15 :
Số lượng electron tham gia hình thành liên kết đơn, đôi và ba lần lượt là:
Số lượng electron tham gia hình thành liên kết đơn, đôi và ba lần lượt là:
Câu hỏi 16 :
Ghép mỗi nguyên tử hoặc phân tử sau với một hoặc các đặc điểm tương ứng của nó: N2, Ar, CO, H2.
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(2) Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(4) Là khí trơ.
(5) Có hai cặp electron hoá trị riêng.
(6) Liên kết trong phân tử là liên kết đơn.
Ghép mỗi nguyên tử hoặc phân tử sau với một hoặc các đặc điểm tương ứng của nó: N2, Ar, CO, H2.
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(2) Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(4) Là khí trơ.
(5) Có hai cặp electron hoá trị riêng.
(6) Liên kết trong phân tử là liên kết đơn.Câu hỏi 19 :
Cho biết hóa trị của một nguyên tố trong phân tử bằng tổng số liên kết σ và π mà nguyên tử nguyên tố đó tạo thành khi liên kết với các nguyên tử xung quanh. Hóa trị của N trong NH4+ là
A. 1
B. 2
C. 3
D. 4
Câu hỏi 22 :
Thiết lập công thức Lewis cho các phân tử H2O, NH3 và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Câu hỏi 26 :
Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.
Giải thích vì sao ở điều kiện thường không tồn tại phân tử NaCl riêng biệt mà là tinh thể NaCl.
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK