Trang chủ
Đề thi & kiểm tra
Lớp 10
Hóa học
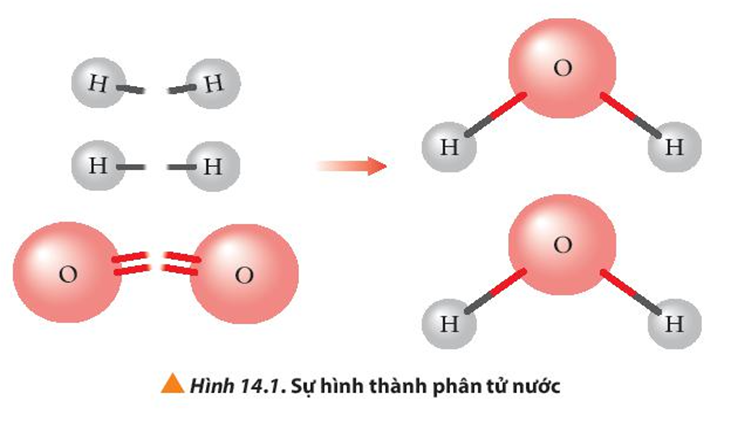
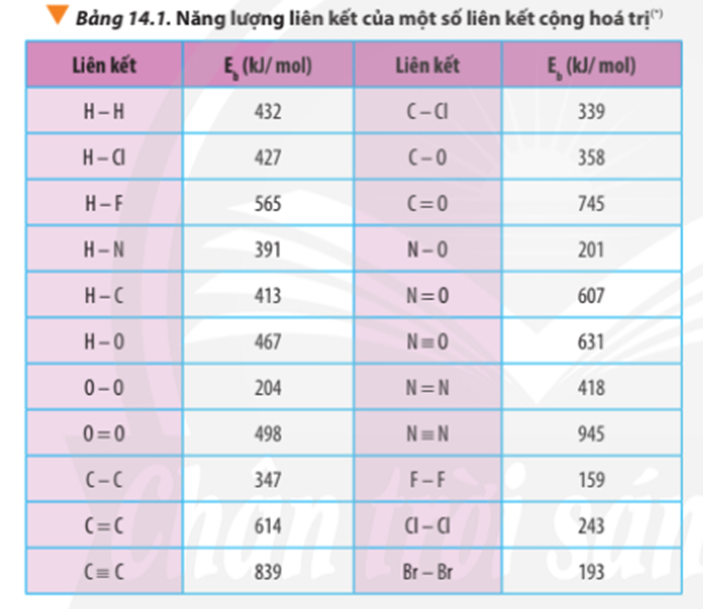
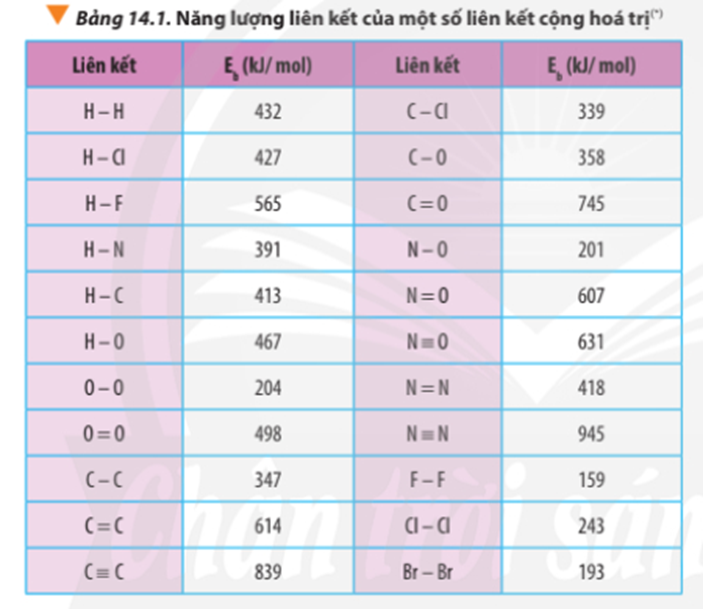
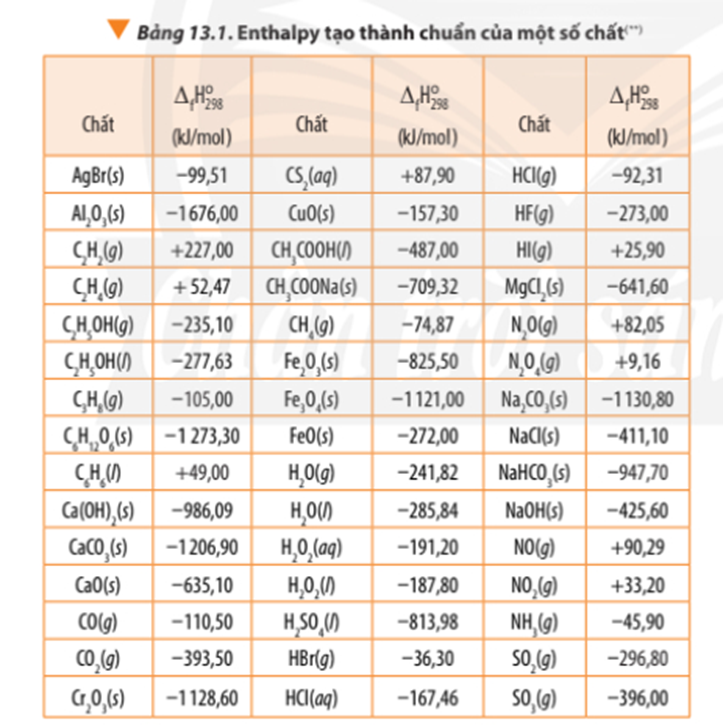
Bài tập Tính biến thiên enthalpy của phản ứng hóa học có đáp án !!
Bài tập Tính biến thiên enthalpy của phản ứng hóa học có đáp án !!
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAPSGK