Hoá học 8 Bài 24: Tính chất của oxi
Tóm tắt bài
- Kí hiệu hóa học của nguyên tố oxi là O
- Công thức hóa học của đơn chất (khí) oxi là O2
- Nguyên tử khối: 16
- Phân tử khối: 32
- Oxi là nguyên tố hóa học phổ biến nhất (chiếm 49,4% khối lượng vỏ Trái Đất). Ở dạng đơn chất, khí oxi có nhiều trong không khí. Ở dạng hợp chất, nguyên tố oxi có trong nước, đường, quặng, đất đá, cơ thể người, động vật và thực vật...
Hình 1: Oxi là nguyên tố phổ biến nhất (chiếm 49,4% khối lượng vỏ Trái Đất)
1.1. Tính chất vật lí
- Chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí. Hoá lỏng ở -1830C.
Hình 2: Trạng thái tự nhiên của khí oxi và oxi lỏng
1.2. Tính chất hóa học
1.2.1. Tác dụng với phi kim
Tác dụng với lưu huỳnh (S)
- Cách tiến hành: Đưa muôi sắt có chứa bột S vào ngọn lửa đèn cồn. Sau đó đưa S đang cháy vào lọ thuỷ tinh có chứa khí oxi.
Video 1: Phản ứng giữa lưu huỳnh và khí Oxi
- Hiện tượng: Lưu huỳnh cháy trong khí oxi mãnh liệt hơn cháy trong không khí, cho ngọn lửa màu xanh.
- Giải thích: Do lưu huỳnh cháy trong oxi tạo thành lưu huỳnh đioxit (SO2), còn gọi là khí sunfurơ) và rất ít lưu huỳnh trioxit (SO3)
- Phương trình phản ứng: S + O2
SO2
Tác dụng với Photpho
- Cách tiến hành: Đốt Photpho đỏ trong khí Oxi
Video 2: Phopho cháy trong khí oxi
- Hiện tượng: Photpho cháy mạnh trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ lưới dạng bột tan được trong nước.
- Giải thích: Bột trắng tạo thành dưới đáy lọ chính là đi photpho pentaoxit có công thức hóa học là P2O5
- Phương trình hóa học: 4P + 5O2
2P2O5
1.2.2. Tác dụng với kim loại
- Cách tiến hành: Quấn thêm vào dây sắt một mẩu than gỗ (mục đích là cung cấp nhiệt độ cho dây sắt nhờ phản ứng cháy của Cacbon) rồi đốt cho dây sắt nóng đỏ rồi đưa vào bình chứa khí Oxi.
Video 3: Sắt cháy trong khí Oxi
- Hiện tượng: Khi cho dây sắt có quấn mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra những hạt nhỏ nóng chảy màu nâu.
- Giải thích: Những hạt nhỏ nóng chảy màu nâu là Sắt (II, III) oxit, công thức hóa học là Fe3O4 thường gọi là sắt từ oxit.
- Phương trình phản ứng: 3Fe + 2O2
Fe3O4
1.2.3. Tác dụng với hợp chất
Khí metan có trong khí bùn ao, phản ứng cháy của metan trong không khí tạo thành khí cacbonic, nước, đồng thời toả nhiều nhiệt.
CH4 + 2O2 .PNG)
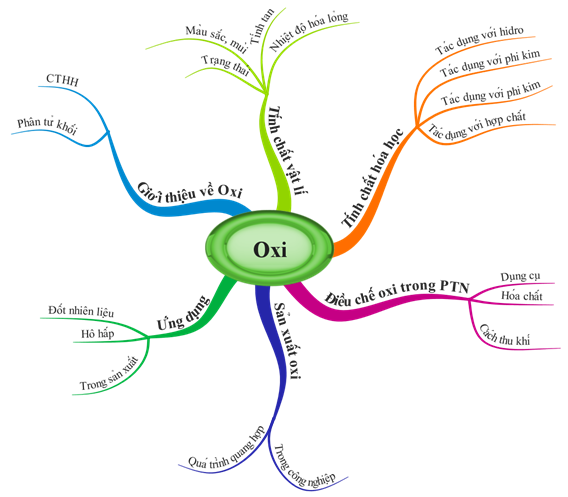
1.3. Tổng kết
Hình 3: Sơ đồ tư duy bài Tính chất của Oxi
Bài 1:
Đốt cháy 6,2g P trong bình chứa 6,72 lit khí oxi ( ở đktc) tạo thành P2O5.
a. Chất nào còn dư, chất nào thiếu?
A. P còn dư, O2 thiếu. B. P còn thiếu, O2 dư.
C. Cả 2 chất vừa đủ. D. Tất cả đều sai.
b. Khối lượng chất tạo thành là bao nhiêu?
A. 15,4g. B. 16g.
C. 14,2g. D. Tất cả đều sai.
Hướng dẫn:
a) Số mol của Photpho tham gia phản ứng là:
\({n_P} = \frac{{{m_P}}}{{{M_P}}} = \frac{{6,2}}{{31}} = 0,2(mol)\)
Số mol oxi tham gia phản ứng là:
\({n_{{O_2}}} = \frac{V}{{22,4}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\)
Phương trình phản ứng: 4P + 5O2 .PNG)
Xét tỉ lệ phản ứng số mol chia cho hệ số phản ứng ta có:
\(\frac{{0,2}}{4} ⇒ Oxi dư, P phản ứng vừa đủ
Vậy ta chọn đáp án D
b) Khối lượng chất tạo thành ta dựa vào số mol của Photpho, là chất phản ứng vừa đủ.
4P + 5O2 .PNG)
4 mol → 2 mol
0,2 (mol) → ? (mol)
Số mol P2O5 tạo thành là:
\({n_{{P_2}{O_5}}} = \frac{{0,2 \times 2}}{4} = 0,1(mol)\)
Khối lượng P2O5 tạo thành là:
\({m_{{P_2}{O_5}}} = {n_{{P_2}{O_5}}}.{M_{{P_2}{O_5}}} = 0,1(31 \times 2 + 16 \times 5) = 14,2(gam)\)
Vậy ta chọn đáp án C
Bài 2:
Đốt cháy hết 3,2 g khí metan trong không khí sinh ra khí cacbonic và nước.
a) Viết phương trình phản ứng
b) Tính thể tích khí oxi (ở đktc)
c) Tính khối lượng khí cacbonic tạo thành.
Hướng dẫn:
a) Phương trình phản ứng: CH4 + 2O2 .PNG)
b) Số mol khí metan tham gia phản ứng là:
\({n_{C{H_4}}} = \frac{m}{M} = \frac{{3,2}}{{12 + 4}} = 0,2(mol)\)
Thay số mol metan vào phương trình ta có:
CH4 + 2O2 .PNG)
1 mol → 2 mol → 1 mol
0,2 mol → ? mol → ? mol
Số mol Oxi tham gia phản ứng là:
\({n_{{O_2}}} = \frac{{0,2 \times 2}}{1} = 0,4(mol)\)
Thể tích khí Oxi tham gia phản ứng là:
\({V_{{O_2}}} = {n_{{O_2}}} \times 22,4 = 0,4 \times 22,4 = 8,96(lit)\)
c) Số mol khí cacbonic tạo thành:
\({n_{C{O_2}}} = \frac{{0,2 \times 1}}{1} = 0,2(mol)\)
Khối lượng khí Cacbonat tạo thành là:
\({m_{C{O_2}}} = {n_{C{O_2}}}.{M_{C{O_2}}} = 0,2.(12 + 16 \times 2) = 8,8(gam)\)
3. Luyện tập Bài 24 Hóa học 8
Sau bài học cần nắm:
- Nguyên tố oxi, về đơn chất phi kim oxi? Các em có nhận xét gì về màu sắc, mùi vị và tính tan trong nước của khí oxi?
- Oxi có thể tác dụng với các chất khác được không? Nếu được thì mạnh hay yếu?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 24 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
-
A.
S + O2
SO2
-
B.
4P + 5O2
2P2O5
-
C.
C + O2
CO2
-
D.
3Fe + 2O2
Fe3O4
-
A.
S + O2
-
Câu 2:
Cháy với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành bình. Là hiện tượng của phản ứng:
-
A.
3Fe + 2O2
Fe3O4
-
B.
CH4 + 2O2
CO2+ 2H2O
-
C.
C + O2
CO2
-
D.
4P + 5O2
2P2O5
-
A.
3Fe + 2O2
-
- A. 16 gam
- B. 32 gam
- C. 64 gam
- D. 48 gam
-
-
A.
CH4 + 2O2
CO2+ 2H2O
-
B.
3Fe + 2O2
Fe3O4
-
C.
C + O2
CO2
-
D.
S + O2
SO2
-
A.
CH4 + 2O2
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 24.
Bài tập 24.8 trang 33 SBT Hóa học 8
Bài tập 24.9 trang 33 SBT Hóa học 8
Bài tập 24.10 trang 33 SBT Hóa học 8
Bài tập 24.11 trang 34 SBT Hóa học 8
Bài tập 24.12 trang 34 SBT Hóa học 8
Bài tập 24.13 trang 34 SBT Hóa học 8
Bài tập 24.14 trang 34 SBT Hóa học 8
Bài tập 24.15 trang 34 SBT Hóa học 8
Bài tập 24.16 trang 34 SBT Hóa học 8
Bài tập 24.17 trang 34 SBT Hóa học 8
Bài tập 24.18 trang 34 SBT Hóa học 8
Bài tập 24.19 trang 34 SBT Hóa học 8
4. Hỏi đáp về Bài 24 Chương 4 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK