Hoá học 8 Bài 17: Bài luyện tập 3
Tóm tắt bài
1.1. Hiện tượng hóa học
-
Hiện tượng hóa học là hiện tượng chất biến đổi có tạo ra chất khác.
-
Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
-
Chất ban đầu bị biến đổi trong phản ứng gọi là chất tham gia hay chất phản ứng.
-
Chất mới sinh ra trong phản ứng gọi là sản phẩm.
-
-
Trong các phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
-
Lưu ý: Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử của nguyên tố khác.
1.2. Phương trình hóa học
-
Phương trình hóa học dùng để biểu diễn ngắn gọn phản ứng hoá học. Gồm công thức hóa học và hệ số thích hợp của những chất tham gia và chất tạo thành.
-
Các bước lập phương trình hóa học:
-
Bước 1: Viết sơ đồ phản ứng gồm công thức hóa học của các chất phản ứng và sản phẩm.
-
Bước 2: Cân bằng số nguyên tử của các nguyên tố có trong phản ứng: Tìm hệ số thích hợp đặt trước các công thức.
-
Bước 3: Viết phương trình hóa học.
-
-
Ví dụ: Lập phương trình hóa học của phản ứng có sơ đồ sau: Al + HCl \(\dashrightarrow\) AlCl3 + H2
-
Bước 1: Trước tiên ta làm chẵn số nguyên tử của H ở bên trái Al + 2HCl \(\dashrightarrow\) AlCl3 + H2
-
Bước 2: Bắt đầu cân bằng số nguyên tử Cl. Bội số chung nhỏ nhất của 2, 3 là 6. Do đó Al + 6HCl \(\dashrightarrow\) 2AlCl3 + H2
-
Bước 3: Cân bằng số nguyên tử Al và H. Hệ số thích hợp của phản ứng là: 2Al + 6HCl → 2AlCl3 + 3H2
-
-
Phương trình hóa học cho biết: Tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
1.3. Tổng kết
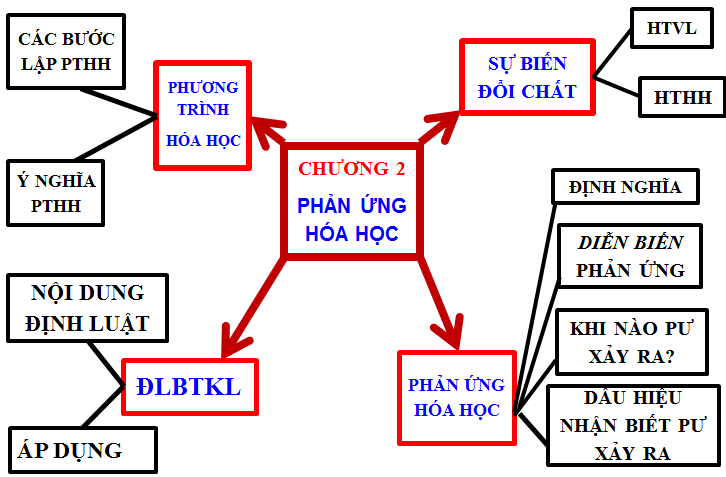
Hình 1: Kiến thức trọng tâm chương Phản ứng hóa học
Bài 1:
Hãy lập phương trình hoá học cho các sơ đồ phản ứng sau:
a. KOH + H2SO4 ------> K2SO4 + H2O
b. P + O2 ------> P2O5
c. K + O2 ------> K2O
d. Al + CuCl2 ------> AlCl3 + Cu
Hướng dẫn:
a. 2KOH + H2SO4 → K2SO4 + 2H2O
b. 4P + 5O2 → 2P2O5
c. 4K + O2 → 2K2O
d. 2Al + 3CuCl2 → 2AlCl3 + 3Cu
Bài 2:
Để điều chế khí O2 người ta nung nóng 30 gam hỗn hợp kaliclorat KClO3 với MnO2 là chất xúc tác thu được 14,9 gam Kaliclorua KCl và 9,6 g khí O2 theo sơ đồ sau: KClO3 ------> KCl + O2
a) Viết sơ đồ trên thành phương trình hóa học
b) Tính khối lượng kaliclorat đã phản ứng
c) Xác định tỉ lệ phần trăm của muối kaliclorat KClO3 có trong hỗn hợp?
Hướng dẫn:
a) Phương trình hóa học:
2KClO3 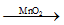
b) Số mol Kaliclorua KCl là: \(n = \frac{m}{M} = \frac{{14,9}}{{74,5}} = 0,2(mol)\)
2KClO3 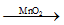
0,2 \(\leftarrow\) 0,2
Khối lượng kaliclorat đã phản ứng là: mKaliClorat = n.M = 0,2.122,5 = 24,5 (gam)
c) Tỉ lệ phần trăm của muối kaliclorat KClO3 có trong hỗn hợp là:
\(\% {m_{KCl{O_3}}} = \frac{{24,5}}{{30}}.100 = 81,67(\% )\)
3. Luyện tập Bài 17 Hóa học 8
Sau bài học cần nắm:
- Kĩ năng phân biệt được hiện tượng hóa học và hiện tượng vật lí
- Lập phương trình hóa học khi biết các chất phản ứng và sản phẩm.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 17 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Khi đốt nóng đường thì ta thấy xuất hiện cacbon và nước
- B. Thủy tinh nóng chảy được thổi thành bình cầu
- C. Trộn bột ( Fe ) với bột (S), ta được hỗn hợp 2 chất với nhau.
- D. Hòa muối ăn với nước ta được hỗn hợp nước đường.
-
- A. Lưu huỳnh cháy tạo ra khí sunfurơ
- B. Cồn để trong lọ bị bay hơi
- C. Than cháy tạo ra khí cacbon đioxit
- D. Đường cháy thành than.
-
- A. Nến chảy lỏng thấm vào bấc.
- B. Nến chảy lỏng chuyển thành hơi nến.
- C. Hơi nến cháy trong không khí tạo ra khí cacbon đioxit và hơi nước.
- D. Cả ba quá trình trên.
Câu 2- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 17.
Bài tập 17.2 trang 23 SBT Hóa học 8
Bài tập 17.3 trang 23 SBT Hóa học 8
Bài tập 17.4 trang 23 SBT Hóa học 8
Bài tập 17.5 trang 23 SBT Hóa học 8
Bài tập 17.6 trang 24 SBT Hóa học 8
Bài tập 17.7 trang 24 SBT Hóa học 8
Bài tập 17.8 trang 24 SBT Hóa học 8
Bài tập 17.9 trang 24 SBT Hóa học 8
Bài tập 17.10 trang 24 SBT Hóa học 8
Bài tập 17.11 trang 24 SBT Hóa học 8
Bài tập 17.12 trang 25 SBT Hóa học 8
Bài tập 17.13 trang 25 SBT Hóa học 8
4. Hỏi đáp về Bài 17 chương 2 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK