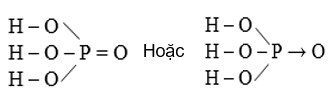Bài giảng Axit photphoric và Muối photphat
Tóm tắt bài
Bài giảng Axit photphoric và Muối photphat
Bài viết hôm nay xin giới thiệu với các bạn về Bài 11 Axit photphoric và muối photphat!
I. Axit Photphoric
1. Cấu tạo phân tử
Photpho có số oxi hóa là +5
2. Tính chất vật lí
- Ở dạng tinh thể màu trắng trong suốt, nung tan chảy ở \( 42,5^0C\). Có đặc tính háo nước và rất dễ bị chảy rữa Rất háo nước nên dễ chảy rữa, dễ dàng tan trong nước ở điều kiện thường.
- Bề ngoài để phân biệt có dạng đặc và sánh, không có màu ở điều kiện thường và có nồng độ 85%.
3. Tính chất hóa học
- Tính axít
- Trong nước \(H_3PO_4\) phân li theo 3 nấc:
\(H_3PO_4 ⇆⇆ H^+ + H_2PO4^-\)
\(H_2PO_4^- ⇆⇆ H^+ + HPO_4^{2-}\)
\(HPO_4^{ 2-} ⇆⇆ H^+ + PO_4^{3-}\)
- Dung dịch \(H_3PO_4\) có tính chất chung của 1 axít và có độ mạnh TB: Nấc 1 > nấc 2 > nấc 3
- Tác dụng với bazơ
- Tuỳ theo tỉ lệ chất tham gia phản ứng mà \(H_3PO_4 \) sinh ra muối axít hoặc muối trung hoà
\(H_3PO_4 + NaOH → NaH_2PO_4 + H_2O (1)\)
\(H_3PO_4 + 2 NaOH → Na_2HPO_4+ 2H_2O (2)\)
\(H_3PO_4 + 3 NaOH → Na_3PO_4 + 3H_2O (3)\)
- \(a=n_{NaOH}n_{H_3PO_4}\)
Nếu \(a ≤≤ 1 → NaH_2PO_4 (1)\)
Nếu \(a = 2 → Na_2HPO_4 (2)\)
Nếu \( a ≥≥ 3 → Na_3PO_4 (3)\)
Nếu 1
Nếu 2
- Không có tính oxi hóa
- Mặc dù Photpho có số oxi hóa cao nhất +5 nhưng H3PO4 không có tính oxi hoá như HNO3 vì trong ion PO43- rất bền vững.
- H3PO4 là axít 3 nấc có độ mạnh trung bình và không có tính oxi hoá.
II. Muối Photphat
1. Có tính tan
- Thường thì không tan trong nước chỉ có muối photphat của các gốc kim loại Na, K mới dễ dàng tan trong trong nước ở điều kiện thường.
- Các gốc muối của các kim loại khác đều ít tan và khó có thể tan trong nước ở điều kiện thường.
2. Cách phát hiện ion của muối photphat
- Sử dụng thuốc thử là dung dịch \(AgNO_3\)
- Dấu hiệu nhận biết là tạo ra chất kết tủa có màu vàng.
- Phản ứng xảy ra như sau: \(3Ag^+ + PO_4^{ 3-} → Ag_3PO_4\) (chất kết tảu có màu vàng)
Giải bài tập - Bài 11. Axit photphoric và muối photphat - Hóa lớp 11
III. Giải bài tập Hóa 11 axit Photphoric và muối Photphat
Bài 1: Cho dung dịch \(H_3PO_4\) và chia chúng thành 3 phần bằng nhau và đem đi phản ứng: Cho 300ml dung dịch NaOH 1,5M cho đem đi thực hiện phản ứng trung hòa. Yêu cầu tìm m?
Hướng dẫn:
\(P1:n_{NaOH}.\dfrac{1}{3}=n_{H_3PO_4}=0,15 mol\)
\(P2+P3:n_{H_3PO_4}=0,3 mol⇒n_{NaOH}=1,5n_{H_3PO_4}\)
⇒ Tạo muối: \(NaH_2PO_4\): x mol và \(Na_2HPO_4\): y mol
⇒ nNaOH =\( x + 2y = 0,45; x + y = 0,3\)
⇒ x = y = 0,15 mol
⇒ Muối gồm 0,15 mol \(NaH_2PO_4\) và 0,15 mol \(Na_2HPO_4\)
⇒ m = 39,3g.
Bài 2: Cho dung dịch \(H_3PO_4\) để tham gia phản ứng, cho hoàn toàn chất tham gia thực hiện phản ứng hết với dung dịch NaOH có khối lượng là m gam, Phản ứng xảy ra tạo ra các chất thành phẩm bao gồm: dung dịch X trong đó có chứa 2,51m gam chất tan. Tìm chất tan sản phẩm X của phản ứng xảy ra?
Hướng dẫn:
Các phản ứng có thể xảy ra:
\((1) 3NaOH + H_3PO_4 → Na_3PO_4 + 3H_2O\)
\((2) 2NaOH + H_3PO_4 → Na_2HPO_4 + 2H_2O\)
\((3) NaOH + H_3PO_4 → NaH_2PO_4 + H_2O\)
Ta thấy: \(n_{NaOH}=n_{H_2O}=0,025m (mol)\)
Bảo toàn khối lượng: \(mH_3PO_4+m_{NaOH}=m_{H_3PO_4}+m_{NaOH}=m_{ct} + m_{H_2O}\)
\(⇒m_{H_3PO_4}=1,61m (g)⇒n_{H_3PO_4}=0,016m (mol)\)
\(⇒n_{NaOH}:n_{H_3PO_4}=0,025m:0,016m=1,52 (1
⇒ Xảy ra phản ứng (2) và (3):
Chất tan là \(Na_2HPO_4, NaH_2PO_4\)
Trên đây là toàn bộ kiến thức mà muốn chia sẻ về lý thuyết và giải bài tập axit Photphoric và muối Photphat!
Bạn có biết?
Học thuộc bài trước khi ngủ. Các nhà khoa học đã chứng minh đây là phương pháp học rất hiệu quả. Mỗi ngày trước khi ngủ, bạn hãy ôn lại bài đã học một lần sau đó, nhắm mắt lại và đọc nhẩm lại một lần. Điều đó sẽ khiến cho bộ não của bạn tiếp thu và ghi nhớ tất cả những thông tin một cách lâu nhất.
Nguồn : timviec365.vnTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK