Lý thuyết Muối clorua chuẩn nhất
Tóm tắt bài
Hidro clorua - Axit clohiđric và muối clorua là một bài trong chương trình Hóa học 10 ở cấp Trung học phổ thông. xin gửi tới các bạn bài tóm tắt lý thuyết và các dạng bài tập phần Muối clorua ngắn gọn và chi tiết nhất. Hy vọng tài liệu này sẽ giúp ích các bạn trong quá trình học tập môn Hóa học 10.
A. Tóm tắt lý thuyết bài 23 Hóa học 10
I - Hidroclorua
1. Cấu tạo phân tử của hidro clorua
- Hidro clorua là một hợp chất cộng hóa trị phân cực, ở phía Clo các cặp electron bị lệch về nhiều hơn vì trong HCl, Hidro có độ âm điện nhỏ hơn Clo.
- Cấu tạo phân tử bao gồm: H-Cl
2 Tính chất vật lý của hidro clorua
- Hidro clorua là một hợp chất khí không có màu, trong suốt, có mùi sốc
- So với không khí, hidro clorua nặng hơn không khí
- Ở trong nước, hidro clorua tan tốt.
II - Axit clohidric
1. Tính chất vật lý của axit clohidric
- Axit clohidric được tạo thành bởi nước và hợp chất hidro clorua
- Các tính chất vật lý của axit clohidric là một chất lỏng không có màu sắc, mùi của axit clohidric sốc.
- Ở \(20^{0}C\), axit clohidric có nồng độ đặc nhất, đạt 37%.
- Trong điều kiện môi trường không khí ẩm, hidroclorua thoát ra bên ngoài kết hợp với hơi nước có trong không khí. Kết quả tạo thành những hạt dung dịch nhỏ giống như sương mù, hay có một tên gọi khác là hiện tượng "bốc khói" của dung dịch HCl.
2. Tính chất hóa học
- Axit clohidric mang tính axit mạnh, thể hiện đầy đủ những tính chất của một axit:
+ Đổi màu quỳ tím, quỳ tím chuyển đỏ
+ Trong dãy hoạt động của các nguyên tố hóa học, axit clohidric tác dụng với những kim loại đứng trước H.
+ Tác dụng được với bazo, muối và oxit bazo.
- Vì trong axit clohidric, -1 là số oxi hóa thấp nhất của Clo nên axit clohidric có tính khử. Và Cl sẽ bị oxi hóa thành \(Cl_{2}\) khi axit clohidric tác dụng với một chất có tính chất oxi hóa mạnh.
\(MnO_{2} + 4HCl \rightarrow MnCl_{2} + Cl_{2} + 2H_{2}O\)
\(2KMnO_{4} + 16HCl \rightarrow 2MnCl_{2} + 2KCl + 5Cl_{2} + 8H_{2}O\)
3. Điều chế dung dịch axit clohidric
a, Điều chế trong phòng thí nghiệm
\(NaCl + H_{2}SO_{4} \overset{< 250^{0}C}{\rightarrow} NaHSO_{4} + HCl\)
\(NaCl + H_{2}SO_{4} \overset{>400^{0}}{\rightarrow} Na_{2}SO_{4} + 2HCl\)
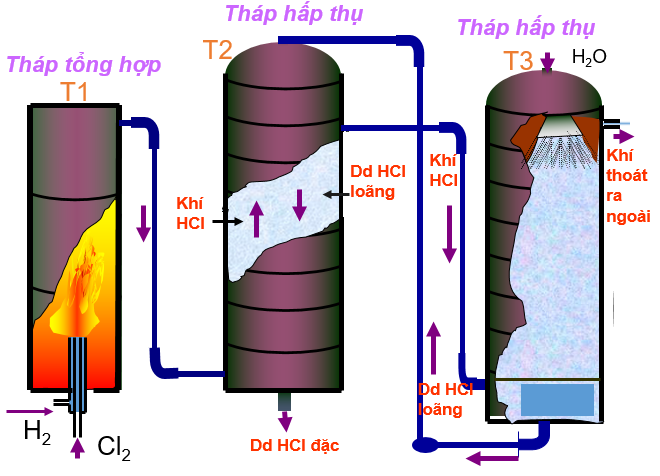
b, Điều chế axit clohiđric trong công nghiệp
Để điều chế axit clohiđric trong công nghiệp, trong khí quyển ta làm phương pháp điện phân muối ăn bão hòa. Kết quả thu được là Clo và Hidro. Đốt khí Clo và Hidro:
\(_{2}^{0}\textrm{H} + _{2}^{0}\textrm{Cl}\) \(\rightarrow\)\(2^{1}_H\)\(^{-1}_{Cl}\)
III - Muối clorua và các ion clorua được nhận biết như thế nào
1. Muối clorua
- Ta có công thức muối clorua là \(MCl_{x}\) với M là một gốc kim loại
- Đặc điểm của muối clorua: Khi cho muối clorua vào nước, trừ các muối clorua là AgCl không tan và CuCl, \(PbCl_{2}\) tan ít trong nước thì đa số các muối clorua còn lại tan nhiều trong nước.
- Hai cặp chất được dùng để điều chế muối clorua là HCl và \(AgNO_{3}\)
- \(FeCl_{3}\) là muối clorua màu vàng nâu
2. Ứng dụng của muối clorua
- Muối clorua có vai trò quan trọng trong sản xuất như làm phân kali từ KCl
- \(ZnCl_{2}\) có khả năng diệt khuẩn nên dùng để bảo quản gỗ như chống mục
- Trong nông nghiệp, \(BaCl_{2}\) làm thuốc trừ sâu,...
- Trong các loại muối clorua, muối quan trọng nhất là NaCl. NaCl ở trong tiêu dùng hàng ngày có tác dụng làm muối ăn, bảo quản thực phẩm. Trong công nghiệp, NaCl là một trong những nguyên liệu quan trọng để điều chế ra Clo, Hidro,...
3. Nhận biết ion clorua
- Để nhận biết ion clorua, người ta dùng \(AgNO_{3}\) làm thuốc thử.
- Cách nhận biết: Trong những dung dịch cần phân biệt, nhỏ vào mỗi ống vài giọt dung dịch \(AgNO_{3}\). Kết quả nếu thấy các muối clorua kết tủa trong axit mạnh thì đấy là HCl hoặc muối clorua
\(AgNO_{3} + HCl \rightarrow AgCl + HNO_{3}\)
\(AgNO_{3} + HCl \rightarrow AgCl + NaNO_{3}\)
B. Các dạng bài tập về muối clorua
I. Các câu hỏi trắc nghiệm
Câu 1: Trong dung dịch HCl, nếu ta nhúng giấy quỳ tím vào thì hiện tượng gì sẽ xảy ra:
A. Giấy quỳ tím chuyển sang đỏ
B. Giấy quỳ tím chuyển sang xanh
C. Giấy quỳ tím giữ nguyên, không đổi màu
D. Giấy quỳ tím bị mất màu
Câu 2: Trong những phát biểu sau đây, phát biểu nào sai
A. Ứng dụng của NaCl trong cuộc sống hàng ngày là bảo quản thực phẩm và làm muối ăn
B. Dung dịch HCl tác dụng với dung dịch \(AgNO_{3}\) cho ra các muối clorua kết tủa
C. Axit clohidric đều có cả hai tính chất đó là tính khử và tính oxi hóa
D. HCl là một chất khí có mùi xốc, không màu và ở trong nước, HCl ít tan
Câu 3: Với dung dịch HCl loãng, dãy các chất nào sau đây đều tác dụng được:
A. \(KNO_{3}, CaCO_{3}, Fe(OH)_{3}\)
B. \(AgNO_{3}, (NH_{4})_{2}CO_{3}, CuS\)
C. \(NaHCO_{3}, AgNO_{3}, CuO\)
D. \(FeS, BaSO_{4}, KOH\)
Câu 4: Trong các phản ứng hóa học sau đây, phản ứng nào HCl thể hiện tính khử của mình:
A. \(HCl + NaOH \rightarrow NaCl + H_{2}O\)
B. \(2HCl + Mg \rightarrow MgCl_{2} + H_{2}\)
C. \(4HCl + MnO_{2} \rightarrow MnCl_{2} +Cl_{2} + H_{2}O\)
D. \(2HCl + CaCO_{3} \rightarrow CaCl_{2} +CO_{2} + H_{2}O\)
Câu 5: Với dung dịch HCl, khi cho một số chất Cu, Ag, Al, Fe, CuO thì chất bị tan hết là:
A. Cu, Al, Fe
B. CuO, Al, Fe
C. Cu, Al, Fe
D. Al, Fe, Ag
Câu 6: Ta có phương trình sau:
\(KMnO_{4} + HCl_{đặc dư} \rightarrow 2KCl + 2MnCl_{2} + 5Cl_{2} + 8H_{2}O\)
Với số lượng của \(KMnO_{4}\) là 23,7g, số lượng lít khí \(Cl_{2}\) thu được là bao nhiêu ở trong điều kiện tiêu chuẩn?
A. 5,27 B. 8,40
C. 3,63 D. 6,50
Câu 7: 3,22g là số lương một hỗn hợp bao gồm các chất Fe, Mg, Zn được hòa tan bởi lượng dung dịch HCl vừa đủ. Trong kết quả, ta thu được một số lượng muối và 1,344 lít khí hidro ở điều kiện tiêu chuẩn. Xác định muối clorua và tính m muối clorua trong kết quả thu được là:
A. 5,23 B. 5,32
C. 7,48 D. 7,84
Câu 8: Để điều chế muối clorua ta chọn cặp chất nào trong những cặp chất sau đây:
A.\(Na_{2}SO_{4}, KCl\) B. \(AgNO_{3}, HCl\)
C. \(Na_{2}SO_{4} , HCl\) D.\(H_{2}SO_{4} , BaCl_{2}\)
Câu 9: Dung dịch HCl 20% là một lượng dùng để một hỗn hợp gồm hai chất Fe và Mg hòa tan một cách hoàn toàn. Kết quả ta thu được một dung dịch, gọi là X. 15,76% là nồng độ phần trăm của \(FeCl_{2}\) ở trong X. Vậy \(MgCl_{2}\) có nồng độ phần trăm là:
A. 23,24% B. 24,23%
C. 11,79% D. 11,97%
Câu 10: Dùng dung dịch HCl dư để 2,96g hỗn hợp gồm ba chất Fe, Zn và Al được hòa tan hoàn toàn. Mặt khác, với khí \(Cl_{2}\) dư, cho phản ứng hoàn toàn với 2,96g X. Kết quả ta thu được một lượng 8,64g muối. Vậy trong 2,96g X, Al chiếm bao nhiêu về khối lượng:
A. 0,54g B. 0,28g
C. 0,82g D. 0,45g
| Câu | Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 |
| Đáp án | A | C | C | C | B | B | D | B | C | A |
II. Bài tập tự luận muối clorua
Bài 1: Ta dùng một lượng dung dịch HCl dư để 20,6g một hỗn hợp gồm hai chất \(Na_{2}Co_{3} \) và \(CaCo_{3} \). Kết quả của phản ứng, ta thu được một lượng khí \(CO_{2}\) và dung dịch chứa 22,8g một hỗn hợp muối. Hỏi trong kết quả thu được có bao nhiêu lít khí \(CO_{2}\)?
Đáp số: V = 4,48 lít
Bài 2: Ta dùng một lượng dung dịch HCl để ngâm 32g một kim loại X với một phương trình hóa học như sau:
\(X + nHCl \rightarrow XCl_{n} + \dfrac{n}{2}H_{2}\)
Nếu 2,24 lít khí thu được ở điều kiện tiêu chuẩn thì kim loại X giảm đi 7,5% khối lượng ban đầu. Hỏi tên kim loại X?
Đáp số: Tên X là Mg
Bài 3: Dùng dung dịch HCl dư vào một lượng m gam hỗn hợp gồm ba chất Zn và Cu. Kết quả ta thu được 4,48 lít khí \(H_{2}\) ở điều kiện tiêu chuẩn và 2g kim loại khi cho các phản ứng xảy ra hoàn toàn. Hỏi m mang giá trị bao nhiêu?
Đáp số: m = 15g
Bài 4: Dùng 0,5 lít dung dịch HCl x mol/l đổ vào một hỗn hợp bao gồm hai chất là Fe và Zn, kết quả ta thu được một lượng 34,575g một chất rắn. Nếu làm tương tự nhưng lượng dung dịch HCl X mol/l là 0,8 lít thì lượng chất rắn thu được là 39,9. Hỏi trong hỗn hợp, lượng Fe chiếm bao nhiêu và giá trị của x?
Đáp số: x = 0,9, lượng Fe là 5,6g
Bài 5: Muốn kết tủa hoàn toàn 200g dung dịch \(AgNO_{3}\) 8,5% thì cần 150ml dung dịch HCl x mol/l . Hỏi nồng độ dung dịch HCl cần dùng là bao nhiêu?
Đáp số: \(C_{m}\) = 0,67M
Bài 6: Dung dịch HCl 20% là một lượng dùng để một hỗn hợp gồm hai chất Fe và Mg hòa tan một cách hoàn toàn. Kết quả ta thu được một dung dịch, gọi là X. 15,76% là nồng độ phần trăm của \(FeCl_{2}\) ở trong X. Vậy \(MgCl_{2}\) có nồng độ phần trăm là bao nhiêu?
Đáp số: 11,79%
Tham khảo thêm >>> Giải bài tập Hóa học 10 bài 23 Hidro clorua, axit clohidric và muối clorua
Với bài Muối Clorua, đã đem lại cho các bạn tóm tắt lý thuyết và các dạng bài tập đầy đủ nhất. Nếu có đóng góp gì cho bài Hidro clorua, Axit clohidric và Muối clorua, hãy để lại comment dưới phần bình luận nhé!
Bạn có biết?
Học thuộc bài trước khi ngủ. Các nhà khoa học đã chứng minh đây là phương pháp học rất hiệu quả. Mỗi ngày trước khi ngủ, bạn hãy ôn lại bài đã học một lần sau đó, nhắm mắt lại và đọc nhẩm lại một lần. Điều đó sẽ khiến cho bộ não của bạn tiếp thu và ghi nhớ tất cả những thông tin một cách lâu nhất.
Nguồn : timviec365.vnTâm sự Lớp 10
Lớp 10 - Năm thứ nhất ở cấp trung học phổ thông, năm đầu tiên nên có nhiều bạn bè mới đến từ những nơi xa hơn vì ngôi trường mới lại mỗi lúc lại xa nhà mình hơn. Được biết bên ngoài kia là một thế giới mới to và nhiều điều thú vị, một trang mới đang chò đợi chúng ta.
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK