Tổng quan về nguyên tử khối và bảng tuần hoàn các nguyên tố Hóa học
Tóm tắt bài
Tổng quan về nguyên tử khối và bảng tuần hoàn các nguyên tố Hóa học
Mỗi một nguyên tố hóa học đều mang trong mình một hóa trị cũng như một nguyên tử khối khác nhau. Chúng thường được phân thành hai loại chính trong bảng tuần hoàn các nguyên tố hóa học là: kim loại và phi kim. Để nắm chắc được kiến thức này, mời các bạn cùng nghiên cứu bài viết dưới đây!
I. Lý thuyết chung
1. Nguyên tử là gì?
Các vật chất cơ bản trên trái đất đều được cấu tạo từ các nguyên tử cơ bản. Các nguyên tử được cấu tạo bao gồm nhân ở giữa và xung qunag là một đám mây điện tích âm các e.
Hạt nhân nguyên tử là thành phần cốt lõi tạo nên một nguyên tử cơ bản chúng giúp liên kết các proton mang trong mình điện tích dương với các neutron trung hòa điện. Trừ nguyên tử hidro thì không có neutron trung hòa điện.
Công thức liên quan:
2. Cấu tạo nguyên tử
- Các hạt cơ bản
Nguyên tử khối gồm có:
+ 1 electron(e) -1
+ Nhân gồm proton(p) +1: 1dvc và neutron(n) 0: 1dvc
- Khối lượng electron: \(m_e /m_p = 1/1840\\ Kl(ng.t) = Kl(nhân)\)
- Cấu tạo nguyên tử khối
\(^X_ZA\) \(\left\{\begin{array}{cc}Z: Bậc \ số \ nguyên \ tử= ∑p \ trong \ nhân\\A= Số \ khối = ∑p + ∑n\end{array}\right.\)
Ví dụ: \(^{12}_6C\)\(\left\{\begin{array}{cc}∑p = 6\\∑n = 12 – 6 = 6\end{array}\right.\)
Nguyên tử khối ở trạng thái cơ bản trung hòa điện: \(∑e = ∑p =6\)
- Cấu hình electron:
\(_1H (1s^1 ) ↑\)
\(_2He (1s^2 ) ↑↓\)
\(_3Li (1s^2 2s^1 ) ↑↓ ↑\)
\(_4Be (1s^2 2s^2 ) ↑↓ ↑↓\)
\(_5B (1s^2 2s^2 2p^1 ) ↑↓ ↑↓ ↑\)
\(_6C (1s^2 2s^2 2p^2 ) ↑↓ ↑↓ ↑ ↑\)
\(_7N (1s^2 2s^2 2p^3 ) ↑↓ ↑↓ ↑ ↑ ↑\)
\(_8O (1s^2 2s^2 2p^4 ) ↑↓ ↑↓ ↑↓ ↑ \)
\(_ 9 F (1s^2 2s^2 2p^5 ) ↑↓ ↑↓ ↑↓ ↑↓ ↑\)
\(_{10}Ne (1s^2 2s^2 2p^6 ) ↑↓ ↑↓ ↑↓ ↑↓ ↑↓\)
II. Bảng nguyên tử khối
a) Vị trí của các nguyên tố trong bảng phân loại tuần hoàn
Là xác định chu kỳ và phân nhóm của nguyên tố bao gồm:
- Chu kỳ: số lượng tử chánh n lớn nhất của ng.tố đó
- Phân nhóm: phân nhóm chánh A và phân nhóm phụ B
Nguyên tố thuộc phân nhóm chánh A là nguyên tố mà e cuối cùng đang xây dựng phân lớp \(n^s hoặc \ n^p\) và phân lớp \((n-1)d; (n-2)f \) không chứa hoặc đã chứa bão hòa: e nsx | \(ns_1 \Rightarrow p.nh I_A\\ ns_2 \Rightarrow p.nh II_A\)
Nguyên tố thuộc phân nhóm phụ B là nguyên tố mà e cuối cùng đang x.d phân lớp \((n-1)d \\ ns_2 (n-1)d^z\).
b) Tính chất của các nguyên tố
- Tính kim loại
Kim loại: là nguyên tố mà ∑e lớp ngoài cùng ≤ 3
Kim loại gồm: phân nhóm \(I_A ; II_A ; III_A\) và các phân nhóm B
- Phi kim
Là nguyên tố mà ∑e lớp ngoài cùng ≥ 4
Phi kim gồm: phân nhóm \(IV_A ; V_A ; VI_A ; VII_A\)
Các nguyên tố thuộc chu kỳ lớn của phân nhóm \(IV_A ; V_A\) là k.l
- Số oxy hóa (+) cao nhất và số oxy hóa (-) thấp nhất.
- Số oxy hóa (+) cao nhất của 1 nguyên tố = ∑e hóa trị của nguyên tố đó e hóa trị là e có thể tham gia tạo liên kết.
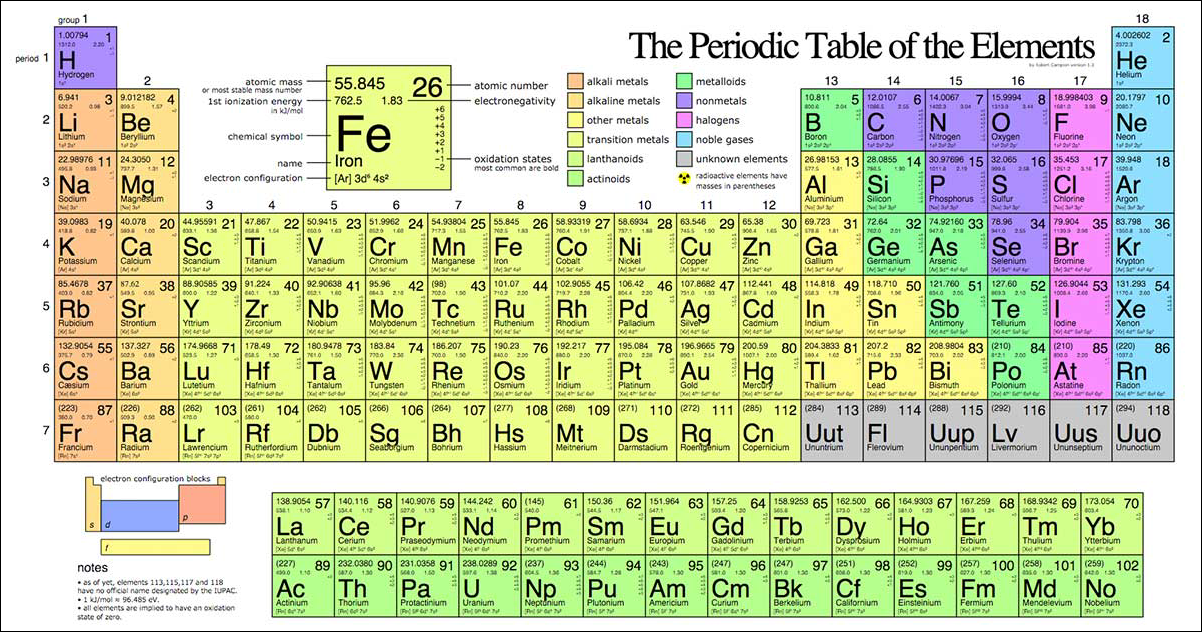
Khối lượng mol ký hiệu là M là khối lượng nguyên tử khối của các nguyên tố được quy định trong bảng tuần hoàn các nguyên tố hóa học. Đơn vị g/mol
Số hiệu nguyên tử chính là số electron có trong ng. tử đó.
Ví dụ 1: Một nguyên tử của nguyên tố X có tổng số hạt proton,electron là 52 và có số khối là 35. Số hiệu nguyên tử khối của nguyên tố X là:
Ta có: p + e = 52
Tổng p + e + n = 52
mà p + n = 35 nên e = 17
Vậy Z = 17
Ví dụ 2: Nguyên tử khối của Ag trên bảng tuần hoàn các nguyên tố hóa học là 47.
Tham khảo thêm tại:
Với những kiến thức tổng hợp trên hy vọng rằng nó đã giúp bạn giải đáp phần nào cách làm dạng bài tập về nguyên tửu khối. Nếu thấy hay nhớ like và chia sẻ nhé. Chúc các bạn có những buổi học vui vẻ!
Bạn có biết?
Học thuộc bài trước khi ngủ. Các nhà khoa học đã chứng minh đây là phương pháp học rất hiệu quả. Mỗi ngày trước khi ngủ, bạn hãy ôn lại bài đã học một lần sau đó, nhắm mắt lại và đọc nhẩm lại một lần. Điều đó sẽ khiến cho bộ não của bạn tiếp thu và ghi nhớ tất cả những thông tin một cách lâu nhất.
Nguồn : timviec365.vnTâm sự Lớp 8
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập bắt đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng các em vẫn phải chú ý sức khỏe nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK
