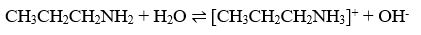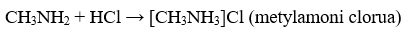Hoá học 12 Bài 9: Amin
Tóm tắt bài
2.1. Khái niệm, phân loại và danh pháp Amin
a. Khái niệm, phân loại
- Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hidrocacbon ta thu được Amin.
- Amin thường có đồng phân về mạch Cacbon, về vị trí nhóm chức và về bậc Amin.
- Phân loại:
- Theo gốc hidrocacbon:
- Amin mạch hở: CH3NH2 (Metylamin), C2H5NH2 (Etylamin),...
- Amin thơm: C6H5NH2 (Phenylamin),...
- Theo bậc của Amin ( Bậc amin thường được tính bằng số gốc hidrocacbon liên kết với nguyên tử N):
- Amin bậc I: CH3NH2, C2H5NH2, ...
- Amin bậc II: CH3-NH-CH3
- Amin bậc III: CH3N(CH3)CH3
- Theo gốc hidrocacbon:
b. Danh pháp
- Danh pháp gốc - chức: tên gốc Hidrocacbon + amin
-
Ví dụ: CH3-NH-CH3 (Đimetylamin); (CH3)3N (Trimetylamin); ...
2.2. Tính chất vật lí của Amin
-
Metyl-, đimetyl-, trimetyl- và etylamin là những chất khí mùi khai, độc, dễ tan trong nước. Các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
-
Anilin là chất lỏng, rất độc, nhiệt độ sôi 184oC, ít tan trong nước, tan trong ancol…
-
Các Amin đều độc.
2.3. Cấu tạo phân tử và tính chất hóa học của Amin
a. Cấu tạo phân tử
- Amin có tính bazơ và dễ bị oxi hóa tương tự NH3.
- Amin còn có tính chất của gốc hidrocacbon.
b. Tính chất hóa học
- Tính bazơ: Dung dịch Metylamin hoặc Propylamin làm màu quỳ chuyển xanh, còn Anilin thì quỳ tím không đổi màu.
-
Tính bazơ của amin phụ thuộc mật độ e trên nguyên tử N: mật độ e lớn, tính bazơ mạnh
-
Gốc HC đẩy e làm tăng tính bazơ
-
Gốc hút e làm giảm tính bazơ
-
Amin béo > NH3 > amin thơm
-
Amin béo bậc II > amin béo bậc I
-
-
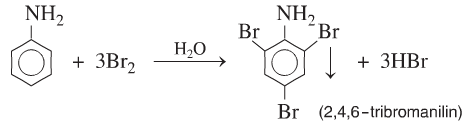
- Phản ứng thế ở nhân thơm của Anilin:
3.1. Bài tập Amin - Cơ bản
Bài 1:
Viết đồng phân amin bậc 1 có công thức C4H11N
Hướng dẫn:
Amin bậc 1 của C4H11N có 4 đồng phân:
\(C - C - C - C - N{H_2}\)
\(C - C - C\left( {N{H_2}} \right) - C\)
\(C - C\left( {C{H_3}} \right) - C - N{H_2}\)
\({\left( {C{H_3}} \right)_3} - C - N{H_2}\)
Bài 2:
Sắp xếp tăng dần tính bazơ của các chất ở dãy sau: NH3, C6H5NH2, CH3NHCH3, CH3CH2NH2.
Hướng dẫn:
- Dựa vào Gốc amin: Gốc đẩy e 3
C6H5NH2 3 3CH2NH2 ,CH3NHCH3
- Dựa vào bậc Amin: Bậc 33
CH3CH2NH2 3NHCH3
⇒ C6H5NH2 3 3CH2NH2 3NHCH3
Bài 3:
Cho 9,3 gam anilin tác dụng với brom dư thì thu được m gam kết tủa. Giá trị của m là:
Hướng dẫn:
C6H5NH2 + 3Br2 → C6H2NH2(Br)3↓ + 3HBr
⇒ mkết tủa = 33 g
Bài 4:
Amin X đơn chức. Cho 0,1 mol X phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được 8,15 gam muối. %mC trong X có giá trị là:
Hướng dẫn:
RNH2 + HCl → RNH3Cl
⇒ namin = nmuối = 0,1 mol
⇒ Mmuối = 81,5g ⇒ R = 29 (C2H5)
Amin là C2H5NH2
⇒ %mC(X) = 53,33%
3.2. Bài tập Amin - Nâng cao
Bài 1:
Cho 20 gam hỗn hợp gồm 3 amin no, đơn chức, là đồng đẳng liên tiếp của nhau tác dụng vừa đủ với dung dịch HCl, cô cạn dung dịch thu được 31,68 gam hỗn hợp muối. Nếu 3 amin trên trộn theo tỷ lệ số mol 1 : 10 : 5 và thứ tự phân tử khối tăng dần thì công thức phân tử của 3 amin là
Hướng dẫn:
\(C_{\bar{n}}H_{2\bar{n}+3}N+HCl\rightarrow C_{\bar{n}}H_{2\bar{n}+3}NHCl\)
a → a → a
\(a=\frac{31,68-20}{36,5}=0,32(mol)\)
\(\bar{M}=\frac{20}{0,32}=14\bar{n}+17\)
\(\bar{n}=3,25\)
Gọi n C có amin (I) 1mol
(n+1) (II) 10mol
(n+2) (III) 5mol
\(\bar{n}=3,25=\frac{n.1+(n+1)10+(n+2)5}{16}\Rightarrow n=2\)
C2H7N, C3H9N, C4H11N
4. Luyện tập Bài 9 Hóa học 12
Sau bài học cần nắm:
- khái niệm, phân loại và cách gọi tên Amin
- tính chất hóa học của Amin.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 9 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. anilin.
- B. iso propyl amin.
- C. butyl amin.
- D. trimetyl amin.
-
- A. 2.
- B. 3.
- C. 4.
- D. 5.
-
- A. Anilin.
- B. Metyl amin
- C. Đimetyl amin
- D. Benzylamin
-
- A. 0,5.
- B. 1,5.
- C. 2,0.
- D. 1,0.
-
- A. Nồng độ của ion CH3NH3+ bằng 0,1M.
- B. Dung dịch X có pH = 13.
- C. Dung dịch X có pH lớn hơn 13.
- D. Nồng độ của ion CH3NH3+ nhỏ hơn 0,1.
-
- A. CH3-NH2
- B. (CH3)2-CH-NH2
- C. CH3-NH-CH3
- D. (CH3)3-N
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 9.
Bài tập 9.3 trang 18 SBT Hóa học 12
Bài tập 9.4 trang 18 SBT Hóa học 12
Bài tập 9.5 trang 18 SBT Hóa học 12
Bài tập 9.6 trang 18 SBT Hóa học 12
Bài tập 9.7 trang 18 SBT Hóa học 12
Bài tập 9.8 trang 19 SBT Hóa học 12
Bài tập 9.9 trang 19 SBT Hóa học 12
Bài tập 9.10 trang 19 SBT Hóa học 12
Bài tập 9.11 trang 19 SBT Hóa học 12
Bài tập 9.12 trang 19 SBT Hóa học 12
Bài tập 3 trang 61 SGK Hóa học 12 nâng cao
Bài tập 4 trang 61 SGK Hóa học 12 nâng cao
5. Hỏi đáp về Bài 9 Chương 3 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 12
Lớp 12 - Năm cuối ở cấp tiểu học, năm học quan trọng nhất trong đời học sinh trải qua bao năm học tập, bao nhiêu kì vọng của người thân xung quanh ta. Những nỗi lo về thi đại học và định hướng tương lai thật là nặng. Hãy tin vào bản thân là mình sẽ làm được rồi tương lai mới chờ đợi các em!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK