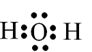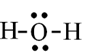Đề thi học kì 1 Hóa học 10 năm 2023 - 2024 gồm 13 đề kiểm tra có đáp án chi tiết kèm theo bảng ma trận đề thi.
Đề kiểm tra Hóa học 10 theo chương trình mới được biên soạn với cấu trúc đề rất đa dạng, bám sát nội dung chương trình học trong sách giáo khoa Kết nối tri thức, Chân trời sáng tạo và Cánh diều. Hi vọng đây sẽ là tài liệu hữu ích cho quý thầy cô và các em ôn tập và củng cố kiến thức, chuẩn bị sẵn sàng cho học kì 1 lớp 10 sắp tới. Vậy sau đây là nội dung chi tiết TOP 13 đề thi kiểm tra học kì 1 Hóa học 10 năm 2023 - 2024, mời các bạn cùng theo dõi tại đây. Bên cạnh đó các bạn xem thêm đề thi học kì 1 Toán 10.
Bộ đề thi học kì 1 môn Hóa học 10 năm 2023 - 2024
1. Đề thi học kì 1 môn Hóa học 10 Kết nối tri thức
1.1 Đề thi cuối học kì 1 môn Hóa học 10
SỞ GD &ĐT ……….. | KIỂM TRA HỌC KÌ 1 |
PHẦN I. TRẮC NGHIỆM (5 ĐIỂM) HS ĐƯỢC PHÉP SỬ DỤNG BẢNG HTTH.
Chọn đáp án đúng nhất và tô tròn vào phiếu trả lời trắc nghiệm.
Câu 1. Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ……
A. các kim loại và phi kim mang điện tích trái dấu.
B. các kim loại mang điện tích trái dấu.
C. các ion mang điện tích trái dấu.
D. các anion mang điện tích.
Câu 2. Quan sát nhóm hình ảnh dưới đây, cho biết đây là ứng dụng của hóa học trong lĩnh vực nào?
A. Nguyên liệu.
B. Hương liệu.
C. Nhiên liệu.
D. Vật liệu
Câu 3. Theo quy tắc octet thì nguyên tử của nguyên tố X có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron bền vững của các khí hiếm với b electron ở lớp ngoài cùng. Giá trị của b là
A. 2.
B. 8.
C. 2 hoặc 8
D. 10.
Câu 4. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử. Điền vào chỗ còn thiếu?
A. cấu tạo của hợp chất.
B. tính chất của nguyên tử.
C. tính chất của hợp chất.
D. cấu tạo của nguyên tử.
Câu 5. Trong bảng hệ thống tuần hoàn, số thứ tự của chu kỳ bằng
A. số electron hoá trị.
B. số hiệu nguyên tử.
C. số lớp electron.
D. số electron lớp ngoài cùng.
Câu 6. Đại lượng đặc trưng cho khả năng hút electron của nguyên tử các nguyên tố khi hình thành liên kết hoá học là
A. Tính phi kim.
B. Độ âm điện.
C. Tính kim loại.
D. Điện tích hạt nhân.
Câu 7. Nguyên tử Y có 1s22s22p63s23p4. Khi hình thành liên kết hóa học, Y có xu hướng hình thành ion Y2- có cấu hình electron là:
A. 1s22s22p63s23p6
B. 1s22s22p63s23p64s2
C. 1s22s22p43s23p6
D. 1s22s22p63s23p2
Câu 8. Nguyên tử 2713Al có:
A. 27p, 27e.
B. 3p, 3e.
C. 13p, 14e.
D. 13p, 13e.
Câu 9. Theo quy tắc octet thì nguyên tử của nguyên tố N có khuynh hướng liên kết với nguyên tử N để đạt được cấu hình electron bền vững của các khí hiếm bằng cách mỗi nguyên tử nitrogen đã

A. cho 3 electron để đạt cấu hình bền.
B. nhận 3 electron để đạt cấu hình bền.
C. góp chung 2 electron tạo nên 2 cặp electron chung.
D. góp chung 3 electron hóa trị tạo nên 3 cặp electron chung.
................
1.2 Đáp án đề thi cuối kì 1 Hóa 10
I. TRẮC NGHIỆM
Đề\câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
101 | C | D | C | C | C | B | A | D | D | C | B | C | A | C | D |
II. TỰ LUẬN
STT | NỘI DUNG | ĐIỂM |
Câu 1. (1 điểm) | a.Ở trạng thái cơ bản, X có 3 lớp electron và có 3 electron độc thân.
Nên cấu hình electron của X: 1s22s22p63s23p3 b. Dự đoán tính chất X: phi kim Giải thích: vì X có 5 electron ở lớp ngoài cùng. | 0,5 0,25 0,25 |
Câu 2. (1 điểm) | Nguyên tử nguyên tố A có 3 lớp electron, lớp ngoài cùng của A có 6 electron. Hãy xác định vị trí của A trong bảng tuần hoàn hóa học (Ô, Nhóm, Chu kì). Giải thích. Nên cấu hình electrong của X: 1s22s22p63s23p4 Vị trí: Ô thứ 16 (STT Ô=Z=16); chu kì 3 (vì STT Chu kì=số lớp lectron=3), Nhóm VIA( vì STT Nhóm=số electron hóa trị= 6; nếu hs giải thích có 6 electron ở lớp ngoài cùng và thuộc nguyên tố p vẫn chấm đúng) HS xác định đúng từng ý kèm giải thích được 0,25 điểm, nếu không giải thích 1 ý vẫn tính điểm tối đa, 2 ý trừ 0,25. | 0,25 0,25 0,25 0,25 |
Câu 3. (1 điểm) | Nguyên tố Y là phi kim; Y thuộc nhóm IVA. Y tạo hợp chất với oxygen và trong công thức oxide cao nhất ; Y chiếm 27,3% về khối lượng. Xác định Y và viết công thức hợp chất này. Công thức oxide cao nhất : YO2 %Y= 27,3 suy ra %O= 100%-%Y= 72,7% Ta có: %Y/%O = MY/M0.2 Thay số vào và rút ra MY=12 Vậy Y là nguyên tố Carbon (C) Công thức hợp chất : CO2 HS giải cách khác vẫn ra MY=12 vẫn cho 0,75 điểm. | 0,25 0, 5 0,25 |
............
Xem đầy đủ đáp án trong file tải về
1.3 Ma trận đề thi học kì 1 môn Hóa học 10
Số TT | Chương/chủ đề | Nội dung/đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng số điểm | ||||||||
Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
TL | TN | TL | TN | TL | TN | TL | TN | TL | TN
|
| |||
(1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) | (14) |
1 | Nhập môn hoá học | Nhập môn hoá học |
| 1 |
|
|
|
|
|
|
| 1 | 1/3 |
2 | Cấu tạo nguyên tử
| 1. Các thành phần của nguyên tử |
| 1 |
|
|
|
|
|
| 1 |
3
| 2 |
2. Nguyên tố hoá học |
| 1 |
|
|
|
|
|
| |||||
3. Cấu trúc lớp vỏ electron nguyên tử |
| 1 | 1 |
|
|
|
|
| |||||
3 | Bảng tuần hoàn các nguyên tố hoá học
| 1. Cấu tạo của bảng tuần hoàn các nguyên tố hoá học |
| 2 | 1 |
|
|
|
|
|
2 |
5
|
2+5/3 |
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm | 1 |
|
|
|
|
| |||||||
3. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì | 1 |
|
| 1 |
|
|
| ||||||
4. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hoá học | 1 |
|
|
|
|
|
| ||||||
4 | Liên kết hoá học
| 1. Quy tắc octet | 2 |
|
|
|
|
| 2 | 6 | 4 | ||
2. Liên kết ion | 2 |
| 1/2 |
| 1 |
| |||||||
3. Liên kết cộng hoá trị | 2 |
| 1/2 |
|
|
| |||||||
Tổng số câu |
| 15 | 2 |
| 2 |
| 1 |
| 5 | 15 | |||
Tỉ lệ % | 0 | 50 | 20 |
| 25 | 0 | 5 | 0 | 50 | 50 | 100 | ||
Tổng hợp chung | 50 | 20 | 25 | 5 | 100 | 10 | |||||||
b. Đặc tả
TT | Chương/ chủ đề |
| Mức độ Nhận thức | Số câu hỏi theo mức độ nhận thức | |||
Nhận biết (TNK) | Thông hiểu (TL) | Vận dụng (TL) | Vận dụng cao (TL) | ||||
1 | Nhập môn hoá học | Nhập môn hoá học | Nhận biết: – Nêu được đối tượng nghiên cứu của hoá học. – Nêu được vai trò của hoá học đối với đời sống, sản xuất,... | 1 | |||
2 | Cấu tạo nguyên tử | 1. Thành phần của nguyên tử | Nhận biết: + Các loại hạt cơ bản tạo nên hạt nhân và lớp vỏ nguyên tử. + Biết các thí nghiệm liên quan đến nguyên tử. | 1 | |||
2. Nguyên tố hoá học | Nhận biết- Nêu được khái niệm nguyên tố hóa học, đồng vị, nguyên tử khối. - Từ số hiều nguyên tử suy ra số e, p. - Nhận biết được các nguyên tử là đồng vị của nhau. - Biết được kí hiệu nguyên tử suy ra số e, p, số khối. | 1 |
| ||||
3. Cấu trúc lớp vỏ electron nguyên tử | Nhận biết -Biết được khái niệm về orbital nguyên tử (AO),lớp electron, phân lớp e. –Mô tả được hình dạng của AO (s, p),số lượng electron trong 1 AO. - Nhận ra được cấu hình e đúng hay sai khi cho cấu hình electron nguyên tử. | 1 |
| ||||
Thông hiểu – Viết được cấu hình electron nguyên tử theo lớp, phân lớp e và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuần hoàn. – Dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử dự đoán được tính chất hoá học cơ bản (kim loại hay phi kim) của nguyên tố tương ứng. |
| 1 | |||||
3 |
Bảng tuần hoàn các nguyên tố hoá học | 1. Cấu tạo bảng tuần hoàn các nguyên tố hoá học | Nhận biết:- Nêu nguyên tắc sắp xếp các nguyên tố trong bảng HTTH. - Nêu được định nghĩa chu kỳ, nhóm A; xác định được mối liên hệ giữa số chu kỳ, nhóm A với cấu tạo nguyên tử; nêu cấu tạo của bảng HTTH; xác định được thông tin của 1 nguyên tố cụ thể thông qua vị trí trong bảng HTTH -Biết được loại nguyên tố (dựa theo cấu hình electron:nguyên tố s, p, d, f Thông hiểu: -xác định được vị trí của 1 nguyên tố thông qua các dữ kiện. |
2 |
1 | ||
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố | Nhận biết: - Nêu được các khái niệm và quy luật biến đổi bán kính nguyên tử, độ âm điện, tính phi kim, kim loại, ... của nguyên tử một số nguyên tố trong một chu kì, một nhóm A. | 1 |
| ||||
3. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì | Nhận biết: Nhận xét được xu hướng biến đổi thành phần và tính chất acid/base của các oxide và các hydroxide theo chu kì. Thông hiểu: Giải được bài tập về oxide | 1 |
| 1 | |||
4. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố | Nhận biết: -Phát biểu được định luật tuần hoàn -Trình bày được ý nghĩa của bảng tuần hoàn các nguyên tố hoá học | 1 |
| ||||
4 |
Liên kết hóa học
| Quy tắc octet | Nhận biết: Trình bày và biết được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A. | 2 |
| ||
Liên kết ion
| Nhận biết: -Trình bày được khái niệm và sự hình thành ion, liên kết ion . - Biết được số electron được nguyên tử nhường hay nhận e để tạo thành ion.. - Nhận biết được cấu hình electron ion sau khi được hình thành . Vận dụng: - Dự đoán loại liên kết trong phân tử. - Xác định cation, anion tạo thành và viết quá trình hình thành ion, liên kết ion , giải thích. Vận dụng cao: -Vận dụng kiến thức giải các bài tập tính toán tổng hợp về ion, hợp chất ion hay các kiến thức liên quan thực tế, ứng dụng . - Vận dụng tìm ra các hợp chất ion khi biết nhiệt độ sôi, nhiệt độ nóng chảy. - Tính toán bài toán thực tế liên quan đến ion, lượng ion có trong thực phẩm , hàng tiêu dùng con người hằng ngày trong lượng cho phép hay cảnh báo vượt mức. |
2 |
|
1/2 |
1 | ||
Liên kết cộng hóa trị | Nhận biết: Trình bày được khái niệm, liên kết đơn, đôi, ba , liên kết cộng hóa trị và xác định được chất chứa liên kết cộng hoá trị . Vận dụng: - Dự đoán loại liên kết trong phân tử -Viết được công thức electron, Lewis, cấu tạo của một số chất. |
2 |
|
1/2 | |||
Học sinh được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hoá học.
2. Đề thi cuối kì 1 Hóa học 10 Cánh diều
2.1 Đề thi cuối kì 1 môn Hóa học 10
SỞ GD &ĐT ……….. | ĐỀ KIỂM TRA HỌC KÌ 1 |
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phát biểu nào sau đây là không đúng ?
A. Hạt nhân nguyên tử được cấu tạo nên bởi các hạt proton, electron, neutron.
B. Trong nguyên tử, số hạt electron bằng số hạt proton.
C. Số khối là tổng số hạt proton (Z) và số hạt neutron (N).
D. Nguyên tử có cấu tạo rỗng.
Câu 2: Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu 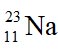 là
là
A. 23.
B. 24.
C. 25.
D. 11.
Câu 3: Cho các kí hiệu nguyên tử: ![]() và các phát biểu sau:
và các phát biểu sau:
(1) X và Y là 2 đồng vị của nhau
(2) X với Y có cùng số khối.
(3) Có ba nguyên tố hóa học.
(4) Z và T thuộc cùng nguyên tố hóa học.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 4: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của calcium (Z = 20) là
A. 3d2.
B. 4s1.
C. 4s2.
D. 3d1.
Câu 5: Phát biểu nào sau đây đúng?
A. Các nguyên tử của nguyên tố khí hiếm đều có 8 electron lớp ngoài cùng.
B. Các nguyên tố mà nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là kim loại.
C. Chỉ các nguyên tố mà nguyên tử có 5, 6 hoặc 7 electron lớp ngoài cùng mới là phi kim.
D. Nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim
Câu 6: Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. proton.
B. neutron.
C. electron.
D. neutron và electron.
Câu 7: Lớp N có số phân lớp là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 8: Ion X2+ có cấu hình electron ở trạng thái cơ bản 1s22s22p6.Nguyên tố X là
A. O (Z = 8).
B. Mg (Z = 12).
C. Na (Z = 11).
D. Ne (Z = 10).
Câu 9: Các nguyên tố trong bảng tuần hoàn hiện tại được sắp xếp không tuân theo nguyên tắc nào sau đây?
A. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
B. Các nguyên tố có cùng số electron hoá trị được xếp vào một cột.
C. Các nguyên tố có cùng số lớp electron được xếp vào một hàng.
D. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Câu 10: Nguyên tố X thuộc chu kì 4. Nguyên tử X có số lớp electron là
A. 6.
B. 5.
C. 7.
D. 4.
Câu 11: Nhóm A bao gồm các nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố s và nguyên tố p.
D. Nguyên tố d và nguyên tố f.
Câu 12: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s²2s²2p6.
B. 1s²2s²2p63s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 13: Nguyên tố R thuộc nhóm VIA. Công thức oxide cao nhất của R là
A. RO2.
B. RO3.
C. R2O5.
D. R2O7.
Câu 14: Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Nhận định nào dưới đây không đúng trong các câu sau khi nói về nguyên tử X?
A. Lớp ngoài cùng của X có 6 electron.
B. Trong bảng tuần hoàn X nằm ở chu kì 3.
C. Hạt nhân nguyên tử X có 16 electron.
D. X nằm ở nhóm VIA.
Câu 15: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C. Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 16: Nguyên tố X ở chu kì 3, nhóm IIIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p63s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 17: Liên kết hydrogen là
A. liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
B. liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
C. liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
D. liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 18: Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm helium khi tham gia hình thành liên kết hóa học?
A. Fluorine.
B. Oxygen.
C. Hydrogen.
D. Chlorine.
Câu 19: Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:

Trong sơ đồ trên, đường nét đứt đại diện cho
A. liên kết cộng hóa trị có cực.
B. liên kết ion.
C. liên kết cho – nhận.
D. liên kết hydrogen.
Câu 20: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là
A. liên kết ion.
B. liên kết cộng hoá trị.
C. liên kết kim loại.
D. liên kết hydrogen.
Câu 21: Chỉ ra nội dung không đúng khi xét phân tử CO2?
A. Phân tử có cấu tạo góc.
B. Liên kết giữa nguyên tử oxygen và carbon là phân cực.
C. Phân tử CO2 không phân cực.
D. Trong phân tử có hai liên kết đôi.
Câu 22: Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là
A. liên kết ion.
B. liên kết cộng hóa trị.
C. liên kết cho - nhận.
D. không xác định được.
Câu 23: Mô tả sự hình thành ion của nguyên tử Ca (Z = 20) theo quy tắc octet là
A. Ca + 2e → Ca2−.
B. Ca→ Ca2+ + 2e.
C. Ca + 6e → Ca6−.
D. Ca + 2e → Ca2+.
Câu 24: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. LiCl.
B. CF2Cl2.
C. CHCl3.
D. N2.
Câu 25: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
A. H2.
B. Cl2.
C. NH3.
D. HCl.
Câu 26: Số hợp chất ion được tạo thành từ các ion F–, K+, O2–, Ca2+ là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 27: Nhóm chất nào sau đây có liên kết “cho – nhận”?
A. NaCl, CO2.
B. HCl, MgCl2.
C. H2S, HCl.
D. NH4NO3, HNO3.
Câu 28: Cho công thức Lewis của các phân tử sau:
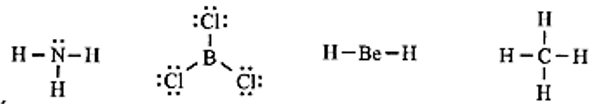
Số phân tử mà nguyên tử trung tâm không thoả mãn quy tắc octet là
A.1
B.2
C.3
D.4
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm):Nêu nội dung quy tắc octet? Trong liên kết hóa học, quy tắc octet giúp giải thích điều gì?
Câu 30 (1 điểm):
a)Viết công thức electron, công thức Lewis và công thức cấu tạo của nước.
b) Viết hai giai đoạn của sự hình thành KF từ các nguyên tử tương ứng (kèm theo cấu hình electron).
Câu 31 (1 điểm): Cho các khí hiếm sau: He (Z = 2), Ne (Z = 10), Ar (Z = 18), Kr (Z = 36), Xe (Z = 54). Khí hiếm nào có nhiệt độ nóng chảy cao nhất. Giải thích.
2.2 Đáp án đề thi cuối kì 1 Hóa học 10
Phần I: Trắc nghiệm
Câu 1:
Đáp án đúng là: A
Phát biểu A không đúng do hạt nhân của hầu hết nguyên tử được cấu tạo nên bởi các hạt proton và neutron.
Câu 2:
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân = số hiệu nguyên tử (Z) = 11.
Câu 3:
Đáp án đúng là: C
Phát biểu đúng là (2); (3); (4)
Phát biểu (1) sai vì X và Y không phải đồng vị của nhau do khác nhau số proton.
Câu 4:
Đáp án đúng là: C
Cấu hình electron nguyên tử Ca: 1s22s22p63s23p64s2.
Vậy cấu hình electron lớp ngoài cùng là: 4s2.
Câu 5:
Đáp án đúng là: D
A sai vì khí hiếm He chỉ có 2 electron ở lớp ngoài cùng.
B và C sai do He có 2 electron lớp ngoài cùng nhưng là khí hiếm; H có 1 electron lớp ngoài cùng nhưng là phi kim …
Câu 6:
Đáp án đúng là: C
Hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Câu 7:
Đáp án đúng là: D
Lớp N (n = 4) có 4 phân lớp 4s, 4p, 4d, 4f.
Câu 8:
Đáp án đúng là: B
X → X2+ + 2e
Þ Cấu hình electron của X là: 1s22s22p63s2.
Vậy X là Mg (Z = 12).
Câu 9:
Đáp án đúng là: D
Bảng tuần hoàn hiện nay được sắp xếp theo các quy tắc sau:
- Các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân nguyên tử.
- Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
- Các nguyên tố mà nguyên tử có cùng số electron hóa trị như nhau được xếp vào cùng một cột.
Câu 10:
Đáp án đúng là: D
Nguyên tố X có số lớp electron = số thứ tự chu kì = 4.
Câu 11:
Đáp án đúng là: C
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Câu 12:
Đáp án đúng là: A
Cấu hình electron nguyên tử Na (Z = 11): 1s22s22p63s1.
Câu 13:
Đáp án đúng là: B
Nguyên tố R thuộc nhóm VIA nên R có hóa trị cao nhất là VI. Công thức oxide cao nhất của R là RO3.
Câu 14:
Đáp án đúng là: C
Phát biểu C sai vì hạt nhân nguyên tử không chứa electron.
Câu 15:
Đáp án đúng là: D
Ô nguyên tố không cho biết số khối của hạt nhân.
Câu 16:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron, nhóm IIIA nên có 3 electron lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X là 1s²2s²2p63s²3p¹.
Câu 17:
Đáp án đúng là: D
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 18:
Đáp án đúng là: C
Nguyên tử hydrogen có 1 electron ở lớp ngoài cùng, có xu hướng đạt cấu hình electron bền vững của khí hiếm helium khi tham gia hình thành liên kết hóa học.
Câu 19:
Đáp án đúng là: D
Trong sơ đồ trên, đường nét đứt đại diện cho liên kết hydrogen.
Câu 20:
Đáp án đúng là: B
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung làliên kết cộng hoá trị.
Câu 21:
Đáp án đúng là: A
Phân tử CO2 có cấu tạo thẳng.
Câu 22:
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p63s23p5 Þ X là phi kim điển hình (nhóm VIIA).
Cấu hình electron nguyên tử Y: 1s22s22p63s1 Þ Y là kim loại điển hình (nhóm IA).
Vậy liên kết giữa X với Y là liên kết ion.
Câu 23:
Đáp án đúng là: B
Cấu hình electron nguyên tử Ca: [Ar]4s2.
Nguyên tử Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững giống khí hiếm.
Ca → Ca2+ + 2e
Câu 24:
Đáp án đúng là: D
Hợp chất cộng hóa trị không phân cực là: N2.
Câu 25:
Đáp án đúng là: B
Ta có:
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
Vậy liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
Câu 26:
Đáp án đúng là: D
Các hợp chất ion có thể được tạo thành là: KF; K2O; CaF2; CaO.
Câu 27:
Đáp án đúng là: D
Câu 28:
Đáp án đúng là: B
Có hai phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là BCl3 và BeH2.
Phần II: Tự luận
Câu 29:
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như khí hiếm.
- Quy tắc octet giúp giải thích một cách định tính (dự đoán) sự hình thành các loại liên kết trong phân tử, đặc biệt là cách viết công thức cấu tạo trong các hợp chất thông thường.
Câu 30:
a)
Công thức phân tử | Công thức electron | Công thức Lewis |
H2O |
|
|
b)
Quá trình hình thành liên kết ion diễn ra như sau:
- Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
K → K+ + 1e
Số electron trên các lớp: 2, 8, 8, 1 2, 8, 8
Cấu hình electron: [Ar]4s1 [Ar]
F + 1e → F-
Số electron trên các lớp: 2, 7 2, 8
Cấu hình electron: [He]2s22p5 [Ne]
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
K+ + F- → KF
Câu 31:
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA (nhóm khí hiếm), bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy cao nhất trong dãy là Xe.
2.3 Ma trận đề thi học kì 1 Hóa học 10
- Thời gian làm bài: 45 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
+ Mức độ đề:40 % Nhận biết; 30 % Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 7,0 điểm, (gồm 28 câu hỏi: nhận biết: 16 câu, thông hiểu: 12 câu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm).
Số TT | Chương/chủ đề | Nội dung/đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng số điểm | ||||||||
Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
TL | TN | TL | TN | TL | TN | TL | TN | TL | TN | ||||
(1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) | (14) |
1 | Nhập môn hóa học | Nhập môn hóa học | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0,25 |
2 | Cấu tạo nguyên tử | 1. Thành phần của nguyên tử | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0,25 |
2. Nguyên tố hoá học | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0,50 | ||
3. Mô hình nguyên tử và orbital nguyên tử | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0,5 | ||
4. Lớp, phân lớp và cấu hình electron | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0,5 | ||
3 | Bảng tuần hoàn các nguyên tố hoá học | 1. Cấu tạo của bảng tuần hoàn các nguyên tố hoá học | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0,50 |
2. Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm | 0 | 1 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 4 | 1,0 | ||
3. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hoá học | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0,5 | ||
4 | Liên kết hoá học | 1. Quy tắc octet | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 1,0 |
2. Liên kết ion | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 2 | 1,5 | ||
3. Liên kết cộng hoá trị | 0 | 3 | 0 | 3 | 1 | 0 | 0 | 0 | 1 | 6 | 2,5 | ||
4. Liên kết hydrogen và tương tác van der Waals | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 1 | 2 | 1,0 | ||
Tổng số câu | 16 | 12 | 3 | 1 | 4 | 28 | |||||||
Tỉ lệ % | 0 | 40 | 0 | 30 | 20 | 0 | 10 | 0 | 30 | 70 | |||
Tổng hợp chung | 40 | 30 | 20 | 10 | 100 | 10 | |||||||
3. Đề thi học kì 1 môn Hóa học 10 Chân trời sáng tạo
3.1 Đề thi Hóa 10 học kì 1
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Cấu tạo của chất và sự biến đổi của chất.
C. Tốc độ của ánh sáng trong chân không.
D. Sự tự quay của Trái Đất quanh trục riêng.
Câu 2: Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân.
B. Nguyên tử trung hòa về điện.
C. Proton và electron có khối lượng gần bằng nhau.
D. Nguyên tử có cấu trúc rỗng.
Câu 3: Một nguyên tử được đặc trưng cơ bản bằng
A. số proton và số đơn vị điện tích hạt nhân.
B. số proton và số electron.
C. số khối và số neutron.
D. số khối và số đơn vị điện tích hạt nhân.
Câu 4:Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau?
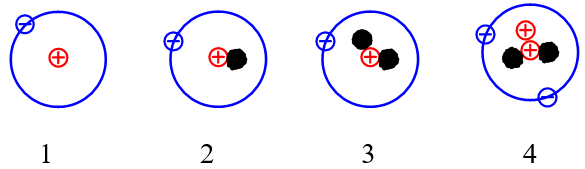
A. 1 và 2.
B. 2 và 3.
C. 1, 2 và 3.
D. 1, 2, 3 và 4.
Câu 5: Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
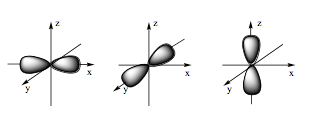
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 6: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 7: Nguyên tử nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. [Ne] 3s23p2.
B. [Ne] 3s23d2.
C. [He] 3s23p2.
D. [Ar] 3s23p2.
Câu 8: Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Số hiệu nguyên tử của nguyên tố hóa học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
Câu 10: Chu kì 4 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
Câu 11: Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do
A. sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
D. sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Câu 12: Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường
A. giảm xuống.
B. tăng dần.
C. biến đổi không theo quy luật.
D. không thay đổi.
Câu 13: Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
A. O. B. F. C. S. D. Si.
Câu 14: X là nguyên tố nhóm IA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O3.
Câu 15: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p3s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 16: Nguyên tố X thuộc nhóm IA, còn nguyên tố Z thuộc nhóm VIIA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là
A. ns1 và ns2np5.
B. ns1 và ns2np7
C. ns1 và ns2np3.
D. ns2 và ns2np5.
Câu 17: Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 18: Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
A. nhường 6 electron
B. nhận 2 electron
C. nhường 8 electron
D. nhận 6 electron
Câu 19: Khi nguyên tử nhận electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
Câu 20: Chất nào sau đây là hợp chất ion?
A. SO2.
B. CO2.
C. K2O.
D. HCl.
Câu 21: Liên kết cộng hoá trị thường được hình thành giữa
A.các nguyên tử nguyên tố kim loại với nhau.
B.các nguyên tử nguyên tố phi kim với nhau.
C.các nguyên tử nguyên tố kim loại với các nguyên tố phi kim.
D.các nguyên tử khí hiếm với nhau.
Câu 22: Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
A. 2. B. 3. C. 5. D. 6.
Câu 23: Số lượng cặp electron dùng chung trong các phân tử O2, N2, F2 lần lượt là
A. 2, 3, 4
B. 2, 3, 1
C. 2, 2, 2
D. 2, 2, 1
Câu 24: Cấu hình electron ở lớp ngoài cùng của nguyên tử nguyên tố X là 3s23p5. Liên kết của nguyên tử này với nguyên tử hydrogen thuộc loại liên kết nào sau đây?
A. Liên kết cộng hóa trị không cực.
B. Liên kết cộng hóa trị có cực.
C. Liên kết ion.
D. Liên kết kim loại.
Câu 25: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p ?
A. H2.
B. NH3.
C. HCl.
D. Cl2.
Câu 26: Nhóm chất nào sau đây có liên kết “cho – nhận”?
A. KCl, CO2.
B. HBr, MgCl2.
C. H2O, HCl.
D. NH4Cl, CO.
Câu 27: Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
A. (a) và (c).
B. (a) và (d).
C. (b) và (c).
D. (b) và (d).
Câu 28: Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O.
B. CH4.
C. CH3OH.
D. NH3.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Câu 30 (1 điểm): Dựa vào giá trị độ âm điện, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2 và NH3.
Nguyên tử | Mg | Al | H | N | Cl | Br | O |
Độ âm điện | 1,31 | 1,61 | 2,20 | 3,04 | 3,16 | 2,96 | 3,44 |
Câu 31 (1 điểm): Giải thích tại sao ở điều kiện thường, các nguyên tố nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
3.2 Đáp án đề thi học kì 1 Hóa 10
Câu 1:
Đáp án đúng là: B
Hóa học là ngành khoa học thuộc lĩnh vực khoa học tự nhiên, nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
Câu 2:
Đáp án đúng là: C
Phát biểu C không đúng vì hạt electron có khối lượng rất nhỏ so với hạt proton.
Câu 3:
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
Câu 4:
Đáp án đúng là: C
Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron dẫn đến số khối của chúng là khác nhau.
Vậy các nguyên tử (1); (2); (3) là đồng vị của nhau do cùng có số proton là 1.
Câu 5:
Đáp án đúng là: B
Orbital p có dạng hình số tám nổi.
Câu 6:
Đáp án đúng là: D
Lớp K, lớp thứ nhất, gần hạt nhân nhất, liên kết chặt chẽ với hạt nhân nhất.
Câu 7:
Đáp án đúng là: A
Cấu hình electron của X: 1s22s22p63s23p2.
Viết gọn: [Ne]3s23p2.
Câu 8:
Đáp án đúng là: A
Số electron độc thân của nguyên tử Al ở trạng thái cơ bản: 1 electron.
Câu 9:
Đáp án đúng là: A
Số hiệu nguyên tử của nguyên tố hóa học bằngsố thứ tự của ô nguyên tố.
Câu 10:
Đáp án đúng là: B
Chu kì 4 của bảng hệ thống tuần hoàn có 18 nguyên tố.
Câu 11:
Đáp án đúng là: C
Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
Câu 12:
Đáp án đúng là: B
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường tăng dần.
Câu 13:
Đáp án đúng là: B
Nhóm IVA | Nhóm VIA | Nhóm VIIA | |
Chu kì 2 | O (Z = 8) | F (Z = 9) | |
Chu kì 3 | Si (Z = 14) | S (Z = 16) |
Theo quy luật biến đổi ta có tính phi kim: Si < S < O < F.
Vây nguyên tố có tính phi kim lớn nhất trong dãy là F.
Câu 14:
Đáp áp đúng là: C
X thuộc nhóm IA nên có hóa trị cao nhất trong hợp chất là I.
Công thức oxide ứng với hóa trị cao nhất của X là X2O.
Câu 15:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s²2s²2p63s².
Câu 16:
Đáp án đúng là: A
X thuộc nhóm IA nên có 1 electron ở lớp ngoài cùng.
Z thuộc nhóm VIIA nên có 7 electron ở lớp ngoài cùng.
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là ns1 và ns2np5.
Câu 17:
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
Đáp án đúng là: B
O (Z = 8): 1s22s22p4
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận vào 2 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Đáp án đúng là: D
Khi nguyên tử nhận electron sẽ tạo thành phần tử mang điện âm (gọi là anion).
Câu 20:
Đáp án đúng là: C
K2O: hợp chất ion;
SO2; CO2; HCl: hợp chất cộng hóa trị.
Câu 21:
Đáp án đúng là: B
Liên kết cộng hoá trị thường được hình thành giữacác nguyên tử nguyên tố phi kim với nhau.
Câu 22:
Đáp án đúng là: A
Các chất trong phân tử chứa liên kết cộng hóa trị phân cực là: H2O; HCl.
Câu 23:
Đáp án đúng là: B
Công thức phân tử | Công thức cấu tạo | Số lượng cặp electron chung |
O2 | O = O | 2 |
N2 | N ≡ N | 3 |
F2 | F - F | 1 |
Câu 24:
Đáp án đúng là: B
X thuộc nhóm VIIA, là phi kim mạnh.
Liên kết giữa X với hydrogen là liên kết cộng hóa trị phân cực (có cực).
Câu 25:
Đáp án đúng là: D
Câu 26:
Đáp án đúng là: D
Câu 28:
Đáp án đúng là: B
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Vậy CH4 không thể tạo được liên kết hydrogen.
Phần II: Tự luận
Câu 29:
- Cấu hình electron K+: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
- Cấu hình electron Mg2+: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron F–: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron S2–: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
Câu 30

Câu 31:
Khi đi từ F2 đến I2, do khối lượng các phân tử tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, nên fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
3.3 Ma trận đề thi học kì 1 Hóa 10
- Thời điểm kiểm tra: Kiểm tra học kì 1 khi kết thúc nội dung: Liên kết hóa học.
- Thời gian làm bài: 45 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40 % Nhận biết; 30 % Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 7,0 điểm, (gồm 28 câu hỏi: nhận biết: 16 câu, thông hiểu: 12 câu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm).
+ Nội dung nửa đầu học kì 1: 25% (2,5 điểm)
+ Nội dung nửa học kì sau: 75% (7,5 điểm
Số TT | Chương/chủ đề | Nội dung/đơn vị kiến thức | Mức độ nhận thức | Tổng số câu | Tổng số điểm | ||||||||
Nhận biết | Thông hiểu | Vận dụng | Vận dụng cao | ||||||||||
TL | TN | TL | TN | TL | TN | TL | TN | TL | TN | ||||
(1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) | (14) |
1 | Mở đầu | Nhập môn Hóa học | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0,25 |
2 | Cấu tạo nguyên tử | 1. Thành phần của nguyên tử | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0,25 |
2. Nguyên tố hoá học | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0,50 | ||
3. Cấu trúc lớp vỏ electron nguyên tử | 0 | 2 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 4 | 1,0 | ||
3 | Bảng tuần hoàn các nguyên tố hoá học | 1. Cấu tạo bảng tuần hoàn các nguyên tố hoá học | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0,50 |
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 4 | 1 | ||
3. Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hoá học | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0,5 | ||
4 | Liên kết hoá học | 1. Quy tắc octet | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 1,0 |
2. Liên kết ion | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 2 | 1,5 | ||
3. Liên kết cộng hoá trị | 0 | 3 | 0 | 3 | 1 | 0 | 0 | 0 | 1 | 6 | 2,5 | ||
4. Liên kết hydrogen và tương tác van der Waals | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 1 | 2 | 1,0 | ||
Tổng số câu | 16 | 12 | 3 | 1 | 4 | 28 | |||||||
Tỉ lệ % | 0 | 40 | 0 | 30 | 20 | 0 | 10 | 0 | 30 | 70 | |||
Tổng hợp chung | 40 | 30 | 20 | 10 | 100 | 10 | |||||||
.................
Tải File tài liệu để xem thêm đề thi học kì 1 môn Hóa học 10