Bài tập xác định công thức hợp chất hữu cơ lớp 11 là tài liệu ôn tập không thể thiếu dành cho các học sinh chuẩn bị thi cuối học kì 1 môn Hóa học. Bài tập lập công thức phân tử hợp chất hữu cơ tổng hợp toàn bộ kiến thức về lý thuyết và các dạng bài tập kèm theo ví dụ minh họa.
Bài tập lập công thức phân tử hợp chất hữu cơ được biên soạn khoa học, phù hợp với mọi đối tượng học sinh có học lực từ trung bình, khá đến giỏi. Qua đó giúp học sinh củng cố, nắm vững chắc kiến thức nền tảng, vận dụng với các bài tập cơ bản và kỹ năng giải đề với các bài tập vận dụng nâng cao. Vậy sau đây là toàn bộ kiến thức về bài tập lập công thức phân tử hợp chất hữu cơ, mời các bạn cùng đón đọc nhé.
Bài tập xác định công thức hợp chất hữu cơ lớp 11
I. Xác định thành phần phần trăm khối lượng
CxHyOzNt (a gam) → mCO2 (g) + mH2O + VN2 (lít)
Ta có:
nC = nCO2=> mC = 12.nCO2 => %C = mC/a .100%
nH= 2nH2O => mH = 2.nH2O => %H = mH/a .100%
nN = 2.nN2 => mN = 28.nN2 => %N = mN/a.100%
%O = 100% - %C - %H - %N
II. Lập công thức đơn giản nhất
Lập công thức đơn giản của hợp chất hữu cơ CxHyOzNt là tìm tỉ lệ:
x : y : z : t = nC : nH : nO : nN hoặc ![]()
III. Lập công thức phân tử hợp chất hữu cơ
1. Dựa vào phần trăm khối lượng các nguyên tố.
Xét sơ đồ: CxHyOz → xC + yH + zO
M (g) 12x (g) y (g) 16.z (g)
100% %C %H %O
Ta có tỉ lệ:

2. Thông qua công thức đơn giản nhất.
Hợp chất hữu cơ X có công thức đơn giản nhất CaHbOc thì CTPT có dạng (CaHbOc)n.
Dựa vào khối lượng mol phân tử của MX tính được n rồi suy ra CTPT của X.
Ví dụ: Chất hữu cơ X có CT ĐGN là CH2O và có khối lượng mol phân tử bằng 180,0 g/mol. Xác định CTPT của X.
Giải: CTPT của X là: (CH2O)n
Vậy: (12 + 2 + 16).n = 180 → n = 6. Vậy CTPT: C6H12O6
Nếu đề bài không cho M thì để tìm n ta phải biện luận như sau:
- Với CTTQ CxHyOz thì y ≤ 2x + 2, chẵn
- Với CTTQ CxHyOzNt thì y ≤ 2x + 2 + t
- Với CTTQ CxHyOzXu thì y ≤ 2x + 2 – u (X là halogen) y lẻ (chẵn) nếu t, u lẻ (chẵn)
3. Tính theo khối lượng sản phẩm đốt cháy.
Phản ứng đốt cháy:
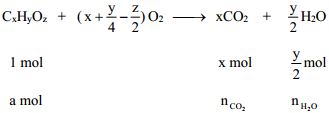
Ta có tỉ lệ: ![]()
Tìm z bằng cách: (12x + y + 16z) = M
IV. Bài tập vận dụng
Bài 1. Hãy thiết lập công thức đơn giản nhất từ các số liệu phân tích sau:
a) %C = 70,94%, %H = 6,40%, %N = 6,90%, còn lại là oxi.
b) %C = 65,92%, %H = 7,75%, còn lại là oxi.
Gợi ý đáp án
a) CxHyOz
%O = 100% – ( 70,94 + 6,4 + 6,9) = 15,76%
Ta có x : y : z : t = 70,94/12/: 6,4/1:15,76/16:6,9/14 =5,91 : 6,40 : 0,99 : 0,49 = 12 : 13 : 2 : 1
Công thức đơn giản nhất: C12H13O2N
b) CxHyOz
%O = 100% – (65,92 + 7,75) = 26,33%
Ta có x : y : z = 65,92/12:7,75/1:26,33/16= 5,49 : 7,75 : 1,65 = 10 : 14 : 3
Công thức đơn giản nhất: C10H14O3
Bài 2. Hợp chất hữu cơ X có phần trăm khối lượng %C = 55,81%, %H = 6,98%, còn lại là oxi.
a) Lập công thức đơn giản nhất của X
b) Tìm CTPT của X. Biết tỉ khối hơi của X so với nitơ xấp xỉ bằng 3,07.
Gợi ý đáp án
Công thức phân tử của X là CxHyOz
Xét tỉ lệ x : y : z = %C/12 : %H/1 : %O/16 = 2 : 3: 1
X là công thức đơn giản nhất là C2H3O → CTPT của X có dạng (C2H3O)n
MX = 28.3,07 = 86,00 (g/mol)
⇒ 43n = 86 nên n = 2.
CTPT của X:C4H6O2
Bài 3. Từ tinh dầu hồi, người ta tách được anetol-một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148,0 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,10%, còn lại là oxi. Lập công thức đơn giản nhất và CTPT của enatol.
Gợi ý đáp án
%O = 100% - 81,08% - 8,1% = 10, 82%
x : y : z = 81,08/12:8,1/1: 10,82/16 = 6,76: 8,1: 0,676
=> Công thức đơn giản nhất là C10H12O
=> (C10H12O)n = 148 => n = 1
=> CTPT: C10H12O
Bài 4. Đốt cháy hoàn toàn 9,0 gam hợp chất hữu cơ A (chứa C, H, O) thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong A.
b) Lập công thức đơn giản nhất của A.
c) Tìm công thức phân tử của A. Biết tỉ khối hơi của A so với khí oxi bằng 1,875.
Gợi ý đáp án
nCO2 = 6,72/22,4= 0,3 mol;
nH2O = 5,4/18=0,3mol
Đốt cháy A chỉ thu được CO2 và H2O nên A chứa C, H và có thể có O.
Bảo toàn nguyên tố C, H ta có
nC(A) = nCO2 = 0,3 mol
nH(A) = 2nH2O = 0,6 mol
Ta có:
mO = mA−mC−mH = 9 − 0,3.12 − 0,6.1 = 4,8 gam
→ nO = 4,8/16 = 0,3 mol
Thành phần phần trăm các nguyên tố trong A là:
%C = (0,3.12/9).100% = 40%
%H = (0,6.1/9).100% = 6,67%
%O = (4,8/9).100% = 53,33%
b.
Ta có: nC : nH : nO = 0,3 : 0,6 : 0,3 = 1 : 2 : 1
Công thức đơn giản nhất của A là: CH2O
c.
Công thức phân tử của A có dạng: (CH2O)n
Ta có: dA/O2 = 1,875 →MA= 1,875.32 = 60
→(12 + 2 + 16).n = 16 → n = 2
Vậy công thức phân tử của A là: C2H4O2
Bài 5. Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X (chứa C, H, O) thu được 11,0 gam CO2 và 6,75 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong X.
b) Lập công thức đơn giản nhất của X.
c) Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với khí hiđro bằng 23.
Gợi ý đáp án
Ta có
nC= nCO2 = 0,25 => %C = 0,25 . 12/5,75 = 52,17%
nH= 2nH2O = 0,75 => %H = 0,75 .1/5,75 = 13,04%
=> %O = 100% -%H - %C = 34,79%
nO= ( mX - mC - mH )/16 = 0,125
X là CxHyOz
=> x : y : z = nC : nH : nO = 0,25 : 0,75 : 0,125 = 2 : 6 : 1
Công thức đơn giản nhất: C2H6O
Công thức phân tử: (C2H6O )n
=> MX = 46n = 23,2
=> n = 1
Công thức hóa học X là C2H60
Bài 6. Đốt cháy hoàn toàn 1,80 gam hợp chất hữu cơ Y (chứa C, H, O) thu được 1,344 lít CO2 (đktc) và 1,08 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong Y.
b) Lập công thức đơn giản nhất của Y.
c) Tìm công thức phân tử của Y. Biết tỉ khối hơi của Y so với khí oxi bằng 5,625.
Gợi ý đáp án
a) Y + O2 → CO2 + H2O
Ta có
nCO2 = 1,344/22,4= 0,06 (mol) --> nC = 0,06 (mol)
→ mC = 0,06.12 = 0,72 (g)
nH2O =1,08/18=0,06 (mol) --> nH= 0,12 (mol)
→mH = 0,12 (g)
%C = 0,7/21,8.100% = 40%
%H = 0,1/21,8.100% = 6,67%
%O = 53,33%
b) mO= 1,8 − 0,72 − 0,12 = 0,96 (g)
nO = 0,96/16 = 0,06 mol
nC:nH:nO= 0,06 0,12 : 0,06 = 1 : 2 : 1
Công thức đơn giản nhất: CH2O
c) MY = 5,625.32 = 180
(CH2O)n = 180-->n = 6
--> Công thức hóa học: C6H12O6
Bài 7. Oxy hóa hoàn toàn 3 g hợp chất hữu cơ A thu được 6,6 g CO2 và 3,6 g nước.
a) Xác định khối lượng các nguyên tố trong A.
b) Tính % theo khối lượng các nguyên tố
Gợi ý đáp án
a)
mC/(CO2)= 6,6.12/44 =1,8 (g)
mH/(H2O)= 3,6.2/18 = 0,4 (g)
=> mC + mH= 1,8 + 0,4 = 2,2(g) <mA= 3 (g)
=> A chứa O (và Vì A là hợp chất hữu cơ) mO = 3 - 2,2 = 0,8(g)
b)
%C =1,8/3.100% = 60%
%H = 0,4/3.100% = 13,33%
%O = 26,67%
Bài 8: Đốt cháy hoàn toàn 10,4g chất hữu cơ A, rồi cho sản phẩm lần lượt qua bình (1) chứa H2SO4 đậm đặc, bình (2) chứa nước vôi trong dư, thấy khối lượng bình (1) tăng 3,6g và bình (2) thu được 30g kết tủa. Khi hóa hơi 5,2g A, thu được một thể tích đúng bằng thể tích của 1,6g khí oxi đo cùng điều kiện nhiệt độ, áp suất. Tìm công thức phân tử của A.
Gợi ý đáp án
Giải thích các bước giải:
Ta có: mbình tăng = mH2O⇒ nH2O= 3,6/18 = 0,2 (mol)
n↓= nCO2= 30/100 = 0,3 (mol)
+) 5,2 gam A có nA= nO2= 1,6/32 = 0,05 (mol)
⇒MA = 10,4/0,1= 104
Bảo toàn khối lượng: nO2 = (3,6 + 0,3.44 − 10,4)/32 = 0,2 (mol)
Bảo toàn Oxi: nO trong A= 0,2 + 0,3.2 − 0,2.2 = 0,4 (mol)
Trong 0,1 mol A có 0,3 mol C; 0,2 mol H2O ⇒ có 0,4 mol H; 0,4 mol O.
⇒ A là C3H4O4
...................
Mời các bạn tải File tài liệu để xem thêm nội dung chi tiết
