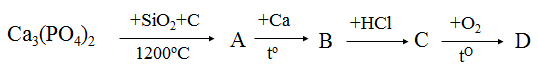Hoá học 11 Bài 10: Photpho
Tóm tắt bài
Video 1: Giới thiệu về Phopho
1.1. Vị trí và cấu hình electron nguyên tử
- Cấu hình e: 1s2 2s2 2p6 3s2 3p3.
- Ví trí: Z = 15, chu kì 3, nhóm VA
- Hoá trị có thể có của P: 5 và 3
1.2. Tính chất vật lí
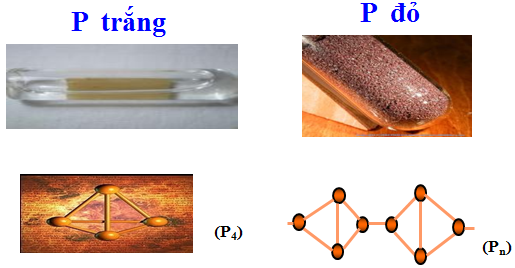
Hình 1: P trắng và P đỏ
|
|
P trắng |
P đỏ |
|
Trạng thái - Màu sắc |
Chất rắn, trong suốt, màu trắng hoặc hơi vàng |
Chất bột, màu đỏ |
|
Tính tan |
Không tan trong nước |
Không tan trong các dung môi thường |
|
Tính độc- Tính bền |
Rất độc, gây bỏng nặng khi rơi vào da - Không bền, dễ bốc cháy trong không khí |
Không độc Bền ở điều kiện thường |
|
Tính phát quang |
Phát quang màu lục nhạt trong bóng tối |
Không phát quang trong bóng tối |
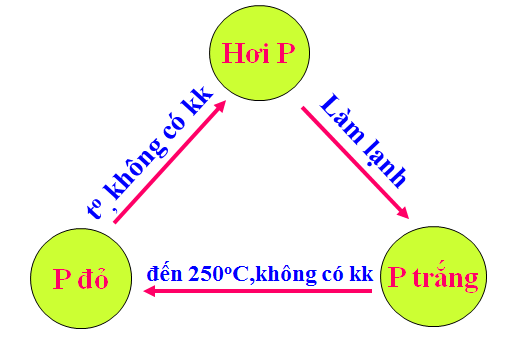
Hình 2: Sơ đồ chuyển hóa giữa Photpho trắng và Photpho đỏ
1.3. Tính chất hóa học
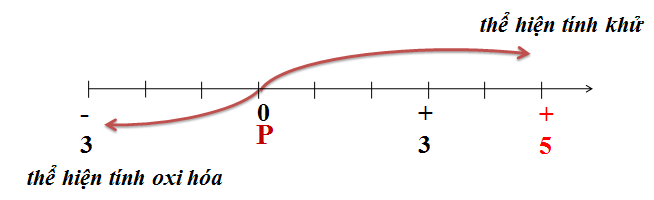
1.3.1. Tính oxi hoá
P + 3Na .PNG)
2P + 3Ca .PNG)
2P + 3Zn .PNG)
1.3.2. Tính khử
- Khi tác dụng với phi kim hoạt động và những chất oxi hoá mạnh.
- Với oxi:
5O2 (dư) + 4P .PNG)
3O2 (thiếu) + 4P .PNG)
Video 2: Phản ứng giữa Photpho và Oxi
- Với clo:
5Cl2 (dư) +2P .PNG)
3Cl2 (thiếu) + 2P .PNG)
- Với hợp chất: P + 5HNO3 đ,n → H3PO4 + 5NO2 + H2O
1.4. Ứng dụng
Hình 3: Ứng dụng của photpho
1.5. Trạng thái tự nhiên
Hình 4: Hai khoáng vật chính của photpho
1.6. Sản xuất
- Trong công nghiệp, photpho đỏ được sản xuất bằng cách nung hỗn hợp quặng photphorit (hoặc apatit), cát và than cốc ở 12000C trong lò điện.
Ca3(PO4)2 + 3 SiO2 + 5C → 5CO + 2Phơi + 3CaSiO3
- Lào Cai là một trong những tỉnh giàu tài nguyên khoáng sản nhất Việt Nam với 35 loại khoáng sản khác nhau. Trong đó có nhiều loại khoáng sản như apatít, đồng, sắt, graphít, nguyên liệu cho gốm, sứ, thuỷ tinh,… với trữ lượng lớn nhất cả nước.
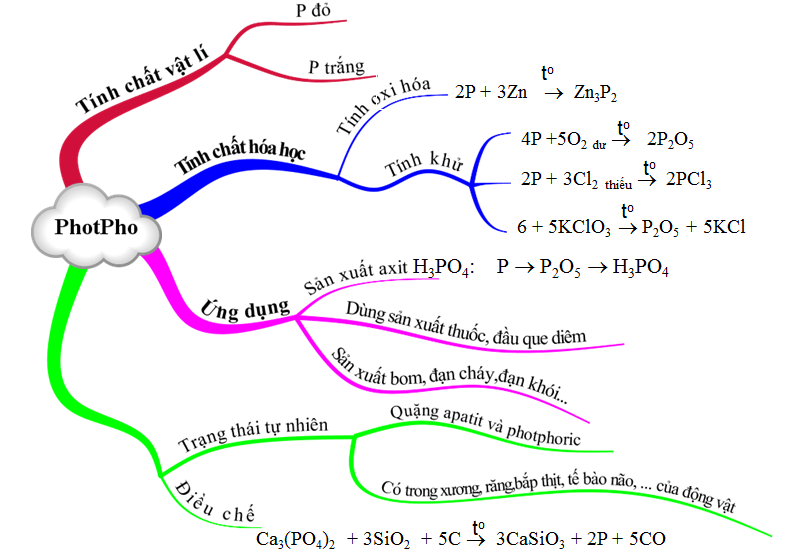
1.7. Tổng kết
Hình 5: Sơ đồ tư duy bài Photpho
Bài 1:
Chọn một phương án đúng để điền cụm từ vào chỗ trống của bảng so sánh tính chất vật lí của P trắng và P đỏ sau:
|
P trắng |
P đỏ |
|
|
Trạng thái, màu sắc |
||
|
Cấu trúc phân tử |
||
| Tính tan | ||
|
Tính độc |
||
|
Tính bền |
||
|
Khả năng phát quang |
(1) chất rắn, trong suốt, màu trắng hoặc vàng nhạt
(2) cấu trúc polime (Pn)
(3) không tan trong nước, tan trong dung môi hữu cơ
(4) chất bột, màu đỏ
(5) phát quang màu lục nhạt trong bóng tối
(6) không độc
(7) không tan trong các dung môi thông thường
(8) bền ở nhiệt độ thường.
(9) không phát quang trong bóng tối
(10) không bền.
(11) rất độc, gây bỏng nặng khi rơi vào da.
(12) cấu trúc mạng tinh thể ptử (P4)
Hướng dẫn:
|
|
P trắng |
P đỏ |
|
Trạng thái, màu sắc |
(1) | (4) |
|
Cấu trúc phân tử |
(12) | (2) |
| Tính tan | (3) | (7) |
|
Tính độc |
(11) | (6) |
|
Tính bền |
(10) | (8) |
|
Khả năng phát quang |
(5) | (9) |
Bài 2:
Giải thích tại sao ở điều kiện thường photpho hoạt động hơn nitơ mặc dù độ âm điện của photpho (2,19) nhỏ hơn độ âm điện của nitơ (3,04)?
Hướng dẫn:
Liên kết trong phân tử photpho là liên kết đơn, kém bền vững hơn liên kết ba trong phân tử nitơ. Vì vậy ở điều kiện thường photpho hoạt động hơn nitơ.
Bài 3:
Dựa vào khả năng bốc cháy khác nhau của photpho trắng và photpho đỏ, cho biết dạng thù hình nào của photpho hoạt động mạnh hơn?
Hướng dẫn:
P trắng hoạt động hóa học mạnh hơn P đỏ.
Bài 4:
Cho các chất sau: Ca3P2, P, P2O3, PCl5, H3PO4.
Hãy xác định số oxi hóa của P.
Cho biết các số oxi hoá có thể có của photpho trong hợp chất. Từ đó dự đoán tính chất hoá học của photpho?
Hướng dẫn:
Số oxi hóa của P ở các chất Ca3P2, P, P2O3, PCl5, H3PO4 lần lượt là: (-3), (0), (+3), (+5), (+5)
Bài 5:
Hoàn thành sơ đồ phản ứng sau: Với D là hợp chất của Photpho
Hướng dẫn:
Các phương trình phản ứng như sau:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO
2P + 3Ca → Ca3P2
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
2PH3 + 4O2 → P2O5 + 3H2O
Vậy A là Phopho, B là Ca3P2, C là PH3, D là P2O5
Bài 6:
Nhận định nào đúng, nhận định nào sai trong các nhận định sau?
|
NHẬN ĐỊNH |
ĐÚNG HOẶC SAI |
|
1. P ở ô thứ 15, chu kì 3, nhóm VA |
Đúng |
|
2. Bảo quản P trắng bằng cách đậy kín trong lọ có không khí |
Sai |
|
3. P đỏ hoạt động mạnh hơn P trắng. |
Sai |
| 4. Trong hợp chất, P có số oxi hóa: -3, +3 và +5 | Đúng |
|
5. P chỉ thể hiện tính oxi hóa khi tác dụng với oxi |
Sai |
|
6. P đỏ phát quang màu lục nhạt trong bóng tối |
Sai |
3. Luyện tập Bài 10 Hóa học 11
Sau bài học cần nắm:
- Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử của nguyên tố photpho.
- Các dạng thù hình, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan, độc tính), ứng dụng, trạng thái tự nhiên và điều chế photpho trong công nghiệp.
- Tính chất hoá học cơ bản của photpho là tính oxi hoá (tác dụng với kim loại Na, Ca...) và tính khử (tác dụng với O2, Cl2).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 11 Bài 10 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. 1,4
- B. 1,6
- C. 1, 3, 5
- D. 2, 4, 5
-
- A. Đều có cấu trúc mạng tinh thể và cấu trúc polime
- B. Tự bốc cháy trong không khí ở điều kiện thường
- C. Tác dụng với kim loại hoạt động tạo photphua
- D. Khó nóng chảy và khó bay hơi
-
Câu 3:
Quặng apatit có công thức
- A. Ca3(PO4)2
- B. 3Ca3(PO4)2.CaF2
- C. CaCO3.MgCO3
- D. Fe3O4
-
- A. Cầm P trắng bằng tay có đeo găng tay.
- B. Dùng cặp gắp nhanh mẩu P trắng ra khỏi lọ và ngâm ngay vào chậu đựng đầy nước khi chưa dùng đến.
- C. Tránh cho P trắng tiếp xúc với nước.
- D. Có thể để P trắng ngoài không khí.
Câu 3- Câu 5: Xem thêm phần trắc nghiệm để làm thử Online
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 11 Bài 10.
Bài tập 10.2 trang 16 SBT Hóa học 11
Bài tập 10.3 trang 17 SBT Hóa học 11
Bài tập 10.4 trang 17 SBT Hóa học 11
Bài tập 10.5 trang 17 SBT Hóa học 11
Bài tập 10.6 trang 17 SBT Hóa học 11
Bài tập 10.7 trang 17 SBT Hóa học 11
Bài tập 1 trang 62 SGK Hóa học 11 nâng cao
Bài tập 2 trang 62 SGK Hóa học 11 nâng cao
Bài tập 3 trang 62 SGK Hóa học 11 nâng cao
Bài tập 4 trang 62 SGK Hóa học 11 nâng cao
Bài tập 5 trang 62 SGK Hóa học 11 nâng cao
Bài tập 6 trang 62 SGK Hóa học 11 nâng cao
4. Hỏi đáp về Bài 10 Chương 2 Hóa học 11
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.
Bạn có biết?
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về các nguyên tố, hợp chất, nguyên tử, phân tử, và các phản ứng hóa học xảy ra giữa những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên khác như vật lý học, địa chất học và sinh học.
Nguồn : Wikipedia - Bách khoa toàn thưTâm sự Lớp 11
Lớp 11 - Năm thứ hai ở cấp trung học phổ thông, gần đến năm cuối cấp nên học tập là nhiệm vụ quan trọng nhất. Nghe nhiều đến định hướng sau này rồi học đại học. Ôi nhiều lúc thật là sợ, hoang mang nhưng các em hãy tự tin và tìm dần điều mà mình muốn là trong tương lai nhé!
Nguồn : ADMIN :))Copyright © 2021 HOCTAPSGK



.PNG)